题目内容
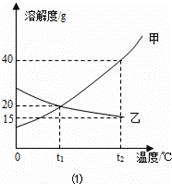
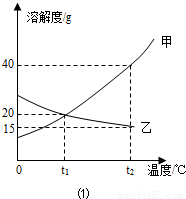
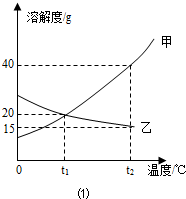
如图1为甲、乙(均不含结晶水)两种固体物质 的溶解度曲线.〔1〕溶解度随温度升高而增大的物质是 (填“甲”或“乙”),t1℃时,甲的溶解度 (填“大于”“小于”或“等于”)乙的溶解度;
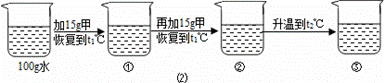
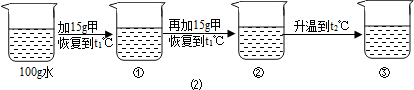
〔2〕某同学在t1℃时开始进行如图2实验,得到相应的溶液①~③.
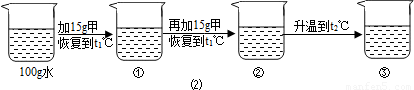
在溶液①~③中属于饱和溶液的是 (填序号)、溶质质量分数最大的是 (填序号);
(3)在溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为 〔精确到0.1%〕.
【答案】分析:(1)根据溶解度曲线和交点的含义考虑;
(2)根据甲物质在t1℃和t2℃的溶解度考虑;
(3)根据饱和溶液溶质质量分数的计算考虑.
解答:解:(1)由曲线可知解度随温度升高而增大的物质是甲;曲线中交点表示该温度时两种物质的溶解度相等,所以t1℃时,甲的溶解度等于乙的溶解度;
(2)甲物质在t1℃溶解度为20g,即100g水中最多溶解20g,①中加入了15g,所以为不饱和溶液,②中加入了30g,所以饱和且有10g没溶解;由于甲物质在t2℃的溶解度是40g,所以升温后原来没溶解的又溶解了,且还不饱和;溶剂不变③中的溶质质量最多,所以质量分数最大;
(3)溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,只能溶解10g,即属于饱和溶液,所以溶质质量分数为: ×100%=28.6%.
×100%=28.6%.
故答案为:(1)甲;等于;(2)②;③;(3)28.6%.
点评:解答本题关键是要知道交点的含义,溶解度的大小比较,饱和溶液的判断方法和溶质质量分数的计算.
(2)根据甲物质在t1℃和t2℃的溶解度考虑;
(3)根据饱和溶液溶质质量分数的计算考虑.
解答:解:(1)由曲线可知解度随温度升高而增大的物质是甲;曲线中交点表示该温度时两种物质的溶解度相等,所以t1℃时,甲的溶解度等于乙的溶解度;
(2)甲物质在t1℃溶解度为20g,即100g水中最多溶解20g,①中加入了15g,所以为不饱和溶液,②中加入了30g,所以饱和且有10g没溶解;由于甲物质在t2℃的溶解度是40g,所以升温后原来没溶解的又溶解了,且还不饱和;溶剂不变③中的溶质质量最多,所以质量分数最大;
(3)溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,只能溶解10g,即属于饱和溶液,所以溶质质量分数为:
 ×100%=28.6%.
×100%=28.6%.故答案为:(1)甲;等于;(2)②;③;(3)28.6%.
点评:解答本题关键是要知道交点的含义,溶解度的大小比较,饱和溶液的判断方法和溶质质量分数的计算.

练习册系列答案
相关题目

 或“等于”)乙的溶解度;
或“等于”)乙的溶解度;