题目内容
1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g ,水两种物质,关于该物质的组成有以下论断 ①一定含碳、氢两种元素 ②一定含有氧元素 ③可能含有氧元素 ④一定不含有氧元素 ⑤该物质分子中碳、氢的原子个数比为1:2 ⑥物质分子中碳、氢的原子个数比为 1:4 ,其中叙述正确的是----------------------------------------------------( )
| A.①②⑤ | B.①④⑤ | C.①④⑥ | D.①③⑥ |
C
本题考查的是质量守恒定律及其应用,原子的有关数量计算,物质的元素组成,化合物中某元素的质量计算。在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变。
1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,根据质量守恒定律可知,参加反应的氧气的质量为:4.4g+3.6g-1.6g=6.4g;4.4g二氧化碳中碳元素的质量为:4.4g×12/44×100%=1.2g,氧元素的质量为:4.4g-1.2g=3.2g;3.6g水中氢元素的质量为:3.6g×2/18×100%=0.4g,氧元素的质量为:3.6g-0.4g=3.2g;分子中C、H的原子个数比为: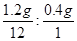 =1:4,由以上计算可知,该物质中含有碳元素和氢元素,不含有氧元素,分子中C、H的原子个数比为1:4。故选C
=1:4,由以上计算可知,该物质中含有碳元素和氢元素,不含有氧元素,分子中C、H的原子个数比为1:4。故选C
1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,根据质量守恒定律可知,参加反应的氧气的质量为:4.4g+3.6g-1.6g=6.4g;4.4g二氧化碳中碳元素的质量为:4.4g×12/44×100%=1.2g,氧元素的质量为:4.4g-1.2g=3.2g;3.6g水中氢元素的质量为:3.6g×2/18×100%=0.4g,氧元素的质量为:3.6g-0.4g=3.2g;分子中C、H的原子个数比为:
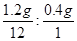 =1:4,由以上计算可知,该物质中含有碳元素和氢元素,不含有氧元素,分子中C、H的原子个数比为1:4。故选C
=1:4,由以上计算可知,该物质中含有碳元素和氢元素,不含有氧元素,分子中C、H的原子个数比为1:4。故选C
练习册系列答案
相关题目

