题目内容
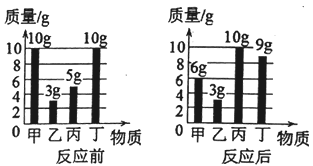
【题目】向100g稀硫酸的烧杯中逐渐加入15g锌粒,产生气体质量与锌粒质量的关系如图所示,请根据关系图分析计算:

(1)稀硫酸反应完时,生成氢气的质量为 g,此时溶液中的溶质是 (填化学式);
(2)该稀硫酸中溶质的质量分数(写出计算过程)。
【答案】(1)0.4;ZnSO4;(2)19.6%
【解析】(1)稀硫酸反应完时,生成氢气的质量为0.4g,此时溶液中的溶质是ZnSO4;
(2)解∶设该稀硫酸中溶质的质量为xg
Zn+H2SO4 =ZnSO4+H2 ↑
98 2
X 0.4g
![]() =
=![]() ,x=19.6g.
,x=19.6g.
该稀硫酸中溶质的质量分数∶![]() ×100%=19.6%.
×100%=19.6%.
答∶(1)稀硫酸反应完时,生成氢气的质量为0.4g,此时溶液中的溶质是ZnSO4;(2)该稀硫酸中溶质的质量分数是19.6%
点睛∶本题主要考查根据化学方程式进行计算。

练习册系列答案
相关题目