题目内容
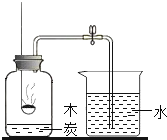
【题目】如图,小试管中盛放着固体乙(足量),滴管中有液体甲,广口瓶中有少量饱和的澄清石灰水(试管底部浸没在澄清石灰水中)。当把甲溶液滴加到乙中,过一会儿可看到石灰水变浑浊了,U形管中的a液面降低、b液面升高了。根据以上现象请你分析下列说法正确的是

A. 甲、乙一定分别是稀盐酸和大理石
B. 甲、乙有可能分别是水和硝酸铵
C. 石灰水变浑浊,一定是发生了化学变化
D. 石灰水变浑浊,有可能是发生了物理变化
【答案】D
【解析】
A、甲、乙分别是稀盐酸和大理石时,可以出现这些现象,但能生成二氧化碳的物质还有很多,例如甲、乙分别是稀硫酸和碳酸钠,甲、乙不一定分别是稀盐酸和大理石,故A错误;
B、甲、乙有分别是水和硝酸铵时溶解吸热.温度降低,氢氧化钙溶解度升高,不会生成沉淀,也不会使容器内压强变大,故B错误;
C、氢氧化钙溶解度随温度的升高而降低,石灰水变浑浊,不一定是发生了化学变化,可能是石灰水温度升高,溶质析出变浑浊,故C错误;
D、氢氧化钙溶解度随温度的升高而降低,石灰水温度升高,溶质析出变浑浊,发生的是物理变化,故D正确。故选D

 华东师大版一课一练系列答案
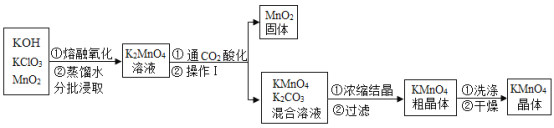
华东师大版一课一练系列答案【题目】工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:
资料查阅:已知相关物质的溶解度(20℃)如下表
物质 | K2CO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 11.1 | 6.34 |
(1)KMnO4中锰元素的化合价为_____。上述流程中可循环利用的物质是_____
(2)“干燥”过程中温度不宜过高的原因是(用化学方程式表示)_____
(3)结合流程和有关信息,补充完整由KMnO4和K2CO3混合溶液中结晶得到KMnO4晶体的实验方案:蒸发浓缩、_____、过滤、洗涤、干燥。
(4)“通CO2酸化”,反应的化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3,若用稀硫酸酸化,反应的化学方程式为:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2X,则X的化学式为_____,工业上不采用稀硫酸酸化的的原因是_____