题目内容
 (1)配制10%的盐酸的步骤有:①稀释②计算③装瓶并贴标签④量取浓盐酸和水.其正确的顺序为
(1)配制10%的盐酸的步骤有:①稀释②计算③装瓶并贴标签④量取浓盐酸和水.其正确的顺序为②④①③
②④①③
(填序号).(2)配制氢氧化钠溶液时,需要的玻璃仪器有量筒、烧杯、滴管及
玻璃棒
玻璃棒
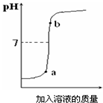
.(3)用配得的氢氧化钠溶液与待测的硫酸溶液反应,实验过程中溶液的pH变化曲线如图所示:a点对应的溶液呈
酸性
酸性
(填“酸性”、“碱性”或“中性”);其对应溶液中溶质为H2SO4、Na2SO4
H2SO4、Na2SO4
(写化学式);b点对应的溶液中的溶质为NaOH、Na2SO4
NaOH、Na2SO4
(写化学式).分析:(1)根据配制溶质质量分数一定的溶液的基本步骤进行分析解答.
(2)实验室配制氢氧化钠溶液操作步骤分别是:计算、称量、溶解,根据各操作所需要使用的仪器进行分析解答.
(3)酸性溶液的pH小于7,碱性溶液的pH大于7,酸和碱能发生中和反应生成盐和水.
(2)实验室配制氢氧化钠溶液操作步骤分别是:计算、称量、溶解,根据各操作所需要使用的仪器进行分析解答.
(3)酸性溶液的pH小于7,碱性溶液的pH大于7,酸和碱能发生中和反应生成盐和水.
解答:解:(1)用浓盐酸配制10%的稀盐酸,先计算出所需浓盐酸和水的质量和体积,再量取浓盐酸和水的体积,然后进行溶解,最后进行装瓶并贴标签.
(2)配制氢氧化钠溶液,首先计算配制溶液所需氢氧化钠和水的质量,再称量所需的氢氧化钠和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,其中属于玻璃仪器的是玻璃棒、烧杯、胶头滴管、量筒.
(3)a点时溶液的pH小于7,溶液呈酸性,此时氢氧化钠与硫酸反应生成的是硫酸钠,且硫酸过量;b点时溶液的pH大于7,溶液呈碱性,说明溶液含有氢氧化钠,氢氧化钠与硫酸反应生成的是硫酸钠,故溶液中含有硫酸钠和氢氧化钠.
故答案为:(1)②④①③;
(2)玻璃棒;
(3)酸性;H2SO4、Na2SO4;NaOH、Na2SO4.
(2)配制氢氧化钠溶液,首先计算配制溶液所需氢氧化钠和水的质量,再称量所需的氢氧化钠和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,其中属于玻璃仪器的是玻璃棒、烧杯、胶头滴管、量筒.
(3)a点时溶液的pH小于7,溶液呈酸性,此时氢氧化钠与硫酸反应生成的是硫酸钠,且硫酸过量;b点时溶液的pH大于7,溶液呈碱性,说明溶液含有氢氧化钠,氢氧化钠与硫酸反应生成的是硫酸钠,故溶液中含有硫酸钠和氢氧化钠.
故答案为:(1)②④①③;
(2)玻璃棒;
(3)酸性;H2SO4、Na2SO4;NaOH、Na2SO4.
点评:本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、所需仪器等是正确解答本题的关键.

练习册系列答案
相关题目