��Ŀ����
����Ŀ����ѧ��һ���о����ʵĿ�ѧ������һ������ʵĴ��ڡ����ʡ��Ʊ�����;�ȷ����о�һ�����ʻ�һ�����ʣ��Խ���Ϊ��������������лش�������⣮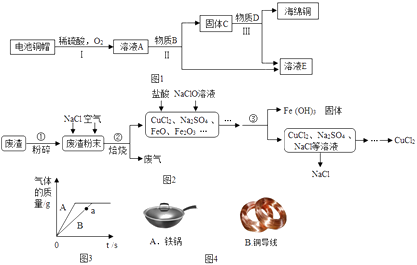
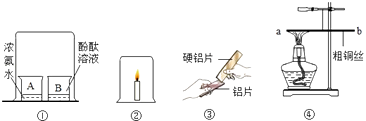
��1����ͼ4������Ʒ�У����ý�����������������������������
��2������������ʱ�Ӵ���һ������������Ҫ�ɷ��ǻ�ԭ���ۣ�������ԭ���������⣬�������ԭ���� �� �Ͼɸ��������������������ȥ����ԭ������д��ѧ����ʽ����
��3�����÷Ͼɵ��ͭñ����Cu��Zn����ȡ����ͭ��Cu�������õ�����п��Һ����Ҫ������ͼ1����Ӧ������ȥ������֪��2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O
2CuSO4+2H2O
��A��E�к�ͭ��п����Ԫ�ص�������������ĸ��ţ���
���ҹ���������ʱ�ڣ����С����������Ϊͭ���ļ������÷�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ
��4�����������ķ����к��д���CuS���������������Ļ������ҵ���Ը÷���Ϊԭ������CuCl2������ͼ��ͼ2��ʾ��
���ڢ���CuS��NaCl��O2�ڸ��������·�Ӧ������CuCl2��Na2SO4 �� �䷴Ӧ�Ļ�ѧ����ʽ�� ��
�ڢ�IJ��������� �� ���������һ��˼·�����ȷ�����������ɳɷ֣�Ѱ�Ҹ��ɷֵIJ��죬Ȼ�����������ѡ����ʷ������з��룬�÷����������û�����в�ͬ�ɷ�������з���ķ�����
��5����������A��B���ֽ����ֱ����������������������ϡ�����ַ�Ӧ����Ӧ��������������뷴Ӧʱ��Ĺ�ϵ��ͼ3��ʾ����A��BΪMg��Zn�е�һ�֣���A�� �� ��Ӧ������ֻ��һ�ֽ���ʣ�࣬��ʣ�����Ϊ ��
���𰸡�
��1�������ԣ������ԣ���չ��
��2����ˮ�������Ӵ���Fe2O3+6HCl�T2FeCl3+3H2O
��3��AC��Fe+CuSO4�TFeSO4+Cu
��4��CuS+2NaCl+2O2 ![]() CuCl2+Na2SO4�����ˣ�������С
CuCl2+Na2SO4�����ˣ�������С
��5��Mg��Mg
���������⣺��1����ͼ4������Ʒ�У���������������������Ϊ���������õĵ����Ժ���չ�ԣ�ͭ�����������ߣ�����Ϊͭ�������õĵ����Ժ���չ�ԣ�
��������ԣ������ԣ���չ�ԣ���2���������ԭ������ˮ�������Ӵ���
�Ͼɸ��������������������ȥ����ԭ������������ϡ���ᷴӦ�����Ȼ�����ˮ����Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+6HCl�T2FeCl3+3H2O��
�����ˮ�������Ӵ���Fe2O3+6HCl�T2FeCl3+3H2O����3����A�к��з�Ӧ���ɵ�����ͭ������п��B�ǹ�����п��C�к���п������ͭ��Ӧ���ɵ�ͭ������п��D������������ͭ��Һ��E������п��Һ�����A��E�к�ͭ��п����Ԫ�ص�������AC��
���AC��
�����������Ϊͭ�����У���������ͭ��Ӧ��������������ͭ���÷�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ��Fe+CuSO4�TFeSO4+Cu��
���Fe+CuSO4�TFeSO4+Cu����4����CuS��NaCl��O2�ڸ��������·�Ӧ������CuCl2��Na2SO4 �� �䷴Ӧ�Ļ�ѧ����ʽ�ǣ�CuS+2NaCl+2O2 ![]() CuCl2+Na2SO4 ��
CuCl2+Na2SO4 ��
���CuS+2NaCl+2O2 ![]() CuCl2+Na2SO4 ��
CuCl2+Na2SO4 ��
�ڢ�IJ��������ǹ��ˣ�
���������û�����в�ͬ�ɷֿ�����С������з���ķ�����
������ˣ�������С����5��þ��п���ã���������A��B���ֽ����ֱ����������������������ϡ�����ַ�Ӧʱ��þ��ϡ����ķ�Ӧ���ʿ죬�����A��BΪMg��Zn�е�һ�֣���A��Mg��
þ��п��ϡ���ᷴӦ�Ļ�ѧ����ʽ���䷴Ӧ��������ϵΪ��
Mg+ | 2HCl | �T | MgCl2+ | H2�� |
24 | 73 |
Zn+ | 2HCl | �T | ZnCl2+ | H2�� |
65 | 73 |
�����Ϲ�ϵ��֪��ϡ�����������ʱ������þ������С��п����������˷�Ӧ������ֻ��һ�ֽ���ʣ�࣬��ʣ�����ΪMg��
���Mg��Mg��
�����㾫����ͨ��������ý������������ʼ���;�ͽ������ϵ�ѡ�����ݣ����ս������������ʣ� ��1��������һ��Ϊ��̬����ΪҺ̬�����н�������2�������������ɫ��ͭΪ�Ϻ�ɫ����Ϊ��ɫ����3�������õĵ����ԡ������ԡ���չ�ԣ���ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ����������������������Խ����⣮

����Ŀ����ͼ��ʾ��ij���Լס��ҡ������������������ŷŵĹ�ҵ��ˮ�зֱ���̼���ơ��Ȼ�ͭ���������ơ������е�һ�֣�ijͬѧ�Ԣ١��ڡ��ۡ��ܴ�ˮ�ʼ��ʱ��¼�����������������ƶϣ��ס��ҡ������������������ŷŹ�ҵ��ˮ�ijɷ֣�������ǣ� ��
�� | �� | �� | �� | |
��¼���� | ��ɫ��Һ | ��ɫ���� | ������ʧ | �������� |
A.�ף�̼����
B.�ң��Ȼ�ͭ
C.��������
D.����̼����