题目内容
【题目】(3分)为测定NaCl和Na2SO4固体混合物中NaCl的质量分数,化学小组同学进行如下实验活动:
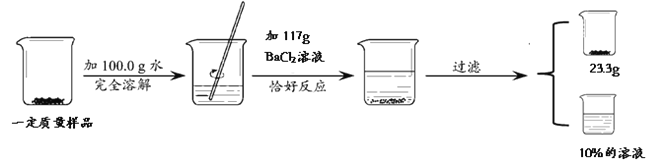
由此测得原固体混合物中NaCl的质量分数是多少?(已知:Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl)
【答案】设样品中氯化钠的质量为y,硫酸钠的质量为z,反应生成氯化钠的质量为x
Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl
142 233 117
z 23.3g x
![]()
X=11.7g z=14.2g
10%=![]() ×100% y=10.1g
×100% y=10.1g
NaCl%=![]() ×100%=41.6%
×100%=41.6%
答:略
【解析】
试题分析:由题意可知,生成的硫酸钡沉淀的质量为23.3g,反应的化学方程式为Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl,利用化学方程式即可求得生成氯化钠的质量和原有硫酸钠的质量;难点是原有氯化钠的质量设为y:已知所得氯化钠溶液质量分数为10%,利用质量守恒定律可得所得溶液的质量为 117g+100g+14.2g—23.3g,溶质为11.7g+y,列式解方程即可求得y;原固体混合物质量即可求得;原固体混合物中NaCl的质量分数即可求得.

练习册系列答案
相关题目
【题目】(6分)某同学利用下图装置验证二氧化碳的相关化学性质。
实验装置 | 实验步骤 | 实验现象 |
| ①向外拉注射器1 | 气球1微微鼓起, 注射器1中溶液变浑浊 |
②将注射器2中的液体推入瓶中 | 气球1继续微微鼓起, …… | |
③打开K,将气球2中的固体氢氧化钠倒入瓶中后, 关闭K | 气球1继续变大, …… |
(1)步骤①中发生反应的化学方程式是 。
(2)补全步骤②中的现象: 。
(3)补全步骤③中的现象: ,其中“气球1继续变大”的原因是 。
(4)通过本实验能验证的二氧化碳的化学性质是_____。