题目内容
【题目】观察下列实验,回答问题: 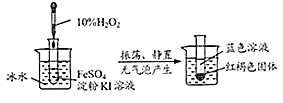
(1)采用冰水浴的原因是 .
(2)写出此实验中反应的化学方程式(其中H2O2与生成单质的化学计量数之比为3:2) .
【答案】
(1)防止过氧化氢分解
(2)2FeSO4+3H2O2+4KI=Fe(OH)3+2I2+2K2SO4
【解析】解:(1)过氧化氢不稳定,会分解生成水和氧气,所以采用冰水浴的原因是:防止过氧化氢分解;(2)硫酸亚铁、过氧化氢和碘化钾反应生成氢氧化铁沉淀、碘和硫酸钾,化学方程式为:2FeSO4+3H2O2+4KI=Fe(OH)3+2I2+2K2SO4 . 所以答案是:(1)防止过氧化氢分解;(2)2FeSO4+3H2O2+4KI=Fe(OH)3+2I2+2K2SO4 .
【考点精析】通过灵活运用书写化学方程式、文字表达式、电离方程式,掌握注意:a、配平 b、条件 c、箭号即可以解答此题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】MgSO4和Na2CO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度S/g | MgSO4 | 25.1 | 28.2 | 30.8 | 32.9 | 34.3 | 35.0 | 34.9 |
Na2CO3 | 21.5 | 39.7 | 49.0 | 48.5 | 46.0 | 45.2 | 43.9 | |
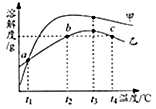
A.甲为Na2CO3
B.乙的饱和溶液从t1升温到t4 , 溶质质量分数增大
C.等质量甲、乙饱和溶液从t3降温到t1 , 析出晶体的质量(不带结晶水):乙>甲
D.b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数