题目内容
【题目】某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下实验方案:
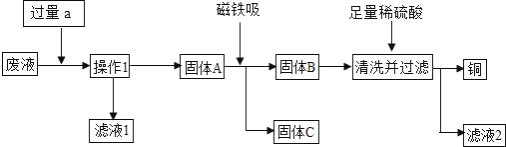
试回答:
(1)操作1是__,固体A的成分__,固体C是__,滤液1和滤液2中溶质相同,该溶质是__.
(2)加入物质a必须过量的原因是__.
(3)要检验加入的稀硫酸是否足量的方法是__.
(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量__(填“>”、“<”或“=”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量__ 的质量.
【答案】 过滤 Cu、Zn、Fe 铁粉 ZnSO4 将废液中的Cu2+和Fe2+全部置换出来 取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量) > 固体D(或铜)
【解析】由题意和实验方案可知该实验的目的是回收金属铁、铜和硫酸锌,故加入的a是金属锌;为了使铁和铜完全置换出来,故加入的锌要过量:锌和硫酸铜反应能生成硫酸锌和铜,锌和硫酸亚铁反应能生成硫酸锌和铁,故固体A是铜、铁和锌,滤液1是硫酸锌;铁能被磁铁吸引,故固体C是铁,那么固体B是锌和铁的混合物;向锌和铜的混合物中加入稀硫酸,稀硫酸能与锌反应生成硫酸锌和氢气,铜不能反应,故通过过滤可分别得到铜,那么滤液2是硫酸锌。(1)通过操作1分别得到了固体和液体,故操作1是过滤;锌能将硫酸铜中的铜、硫酸亚铁中的铁置换出来,由于加入的锌是过量的,故固体A是铜、铁和锌的混合物;铁能被磁铁吸引,故固体C是铁;锌和硫酸铜反应能生成硫酸锌和铜,锌和硫酸亚铁反应能生成硫酸锌和铁,故滤液1中的溶质是硫酸锌;稀硫酸能与锌反应生成硫酸锌和氢气,故滤液2 的溶质是硫酸锌,即滤液1和滤液2中溶质相同均是硫酸锌;(2)步骤①中锌粉必须过量的原因是:将废液中的Cu2+和Fe2+全部置换出来;(3)加入稀硫酸的目的是将铜锌混合物中的锌除去,故检验加入的稀硫酸是否足量的方法是取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量;(4)若实验过程中的物质损失忽略,因为锌与硫酸铜反应生成铜和硫酸锌,锌与硫酸亚铁反应生成铁和硫酸锌,生成了很多的硫酸锌,最终所得硫酸锌的质量大于原废液中硫酸锌的质量;要计算该废液中硫酸铜质量,必须要称量铜的质量,利用化学方程式,根据铜与硫酸铜的质量比即可计算出硫酸铜的质量。