题目内容
【题目】实验室制取气体时要考虑下列问题:
(1)依据原理,确定制取方案:
①实验室制取O2时选择的药品在组成上的共同点是_____。
②写出氯酸钾和二氧化锰制氧气的反应符号表达式_____。
(2)选择合理的制取装置。
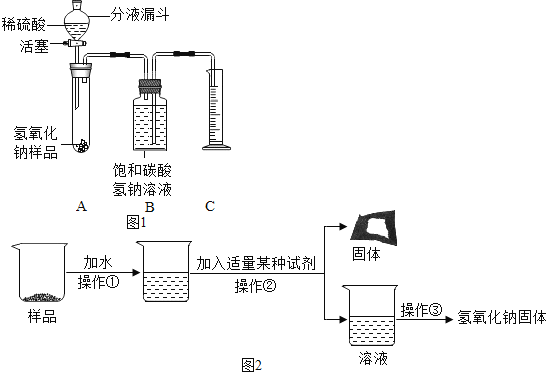
用如图所示装置制取气体,请回答下列问题。

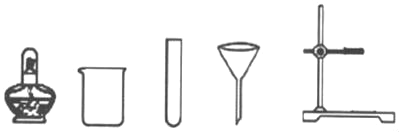
①仪器a的名称是_____。
②选用A装置加热高锰酸钾制氧气,装置需要改进的地方是_____,反应的符号表达式为_____。
③用双氧水和二氧化锰制取O2,选择的发生和收集装置的组合是_____(写出一种组合,填序号)。
④实验室在加热条件下,分解草酸晶体可以制得CO,但是加热时草酸晶体在分解之前先熔化成了液体。如果用这种方法制取CO,你从A、B、C中所选择的发生装置是_____(填序号),选择的理由是_____。
⑤检查D装置气密性的方法是_____。
(3)探究制取氧气的适宜催化剂。实验方案如下:
Ⅰ、用MnO2、CuO、Fe2O3、Cr2O3(氧化铬)四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用,
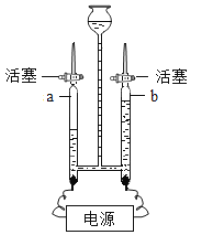
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用如图所示装置进行实验。请写出该反应的符号表达式_____,二氧化锰的作用是_____,改用其他三种微球,分别重复上述实验,得到锥形瓶内压强随时间变化的曲线图。
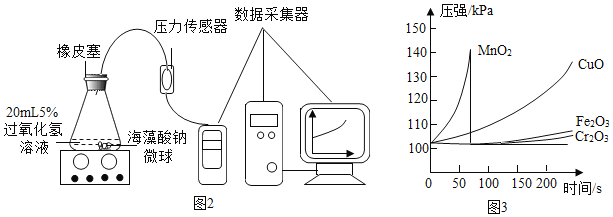
①每次实验时,海藻酸钠微球数应相同的原因_____。
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是_____。
③从实验曲线看,催化效果较好、反应温和的催化剂是_____。
【答案】物质中都含有氧元素 2KClO3![]() 2KCl+3O2↑; 酒精灯; 在试管口放一团棉花, 2KMnO4
2KCl+3O2↑; 酒精灯; 在试管口放一团棉花, 2KMnO4![]() K2MnO4+MnO2+O2↑ ;DE或DG; C, 反应物是固体,反应条件是加热; 通过长颈漏斗向锥形瓶中注水直至浸没长颈漏斗末端,在导管上连接橡皮管,用弹簧夹夹紧,继续通过长颈漏斗注水直至形成液面差,一段时间后液面差不变,说明装置不漏气; 2H2O2
K2MnO4+MnO2+O2↑ ;DE或DG; C, 反应物是固体,反应条件是加热; 通过长颈漏斗向锥形瓶中注水直至浸没长颈漏斗末端,在导管上连接橡皮管,用弹簧夹夹紧,继续通过长颈漏斗注水直至形成液面差,一段时间后液面差不变,说明装置不漏气; 2H2O2![]() 2H2O+O2↑, 催化作用; 确保催化剂用量一致; 产生气体的速率过快,导致气压过大,橡皮塞被弹出; CuO。
2H2O+O2↑, 催化作用; 确保催化剂用量一致; 产生气体的速率过快,导致气压过大,橡皮塞被弹出; CuO。
【解析】
(1)①化学反应前后,元素种类不变,所以所以实验室制取O2时选择的药品在组成上的共同点是:物质中都含有氧元素;
②氯酸钾在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(2)①通过分析题中所指仪器的名称和作用可知,a是酒精灯;
②实验室用高锰酸钾制取氧气时,需要在试管口放一团棉花,防止高锰酸钾粉末进入导管,所以装置需要改进的地方是:在试管口放一团棉花,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
③过氧化氢制取氧气的反应物是固体和液体,反应条件是常温,氧气密度比空气大,不易溶于水,所以选择的发生和收集装置的组合是DE或DG;
④实验室在加热条件下,分解草酸晶体可以制得CO,加热时草酸晶体在分解之前先熔化成了液体,所以所选择的发生装置是C,选择的理由是:反应物是固体,反应条件是加热;
⑤利用检验装置气密性利用装置内外的压强差检验,所以检查D装置气密性的方法是:通过长颈漏斗向锥形瓶中注水直至浸没长颈漏斗末端,在导管上连接橡皮管,用弹簧夹夹紧,继续通过长颈漏斗注水直至形成液面差,一段时间后液面差不变,说明装置不漏气;
(3)过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑,二氧化锰是该反应的催化剂,起催化作用;
2H2O+O2↑,二氧化锰是该反应的催化剂,起催化作用;
①每次实验时,海藻酸钠微球数应相同是为了确保催化剂用量一致;
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,可能是因为产生气体的速率过快,导致气压过大,橡皮塞被弹出;
③从实验曲线看,二氧化锰太剧烈,氧化铁和三氧化二铬太慢,故催化效果较好、反应温和的催化剂是CuO。

【题目】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 3.0g |
第二次加入10g | 2.0g |
第三次加入10g | 1.0g |
第四次加入10g | 0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)
【题目】某课外活动小组进行如下实验探究。
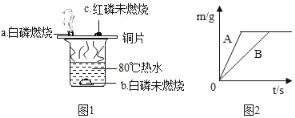
(1)验证物质的燃烧条件
根据图1进行实验,实验现象如图所示。
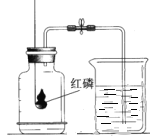
①80℃热水的作用是_____,_____。
②比较现象a、c,得出燃烧的条件是_____。
(2)①将一定质量的锌粒投入含有Cu(NO3)2和Fe(NO3)2的混合溶液中,充分反应后过滤,若滤液中只含一种溶质,则滤渣中一定含有_____。(填化学用语)
②在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图2所示。下列表述不正确的是_____(填序号)。
①A表示锌和稀硫酸的反应曲线 ②反应结束后消耗两种金属的质量相等
③反应结束后两种金属一定都有剩余 ④反应结束后稀硫酸都没有剩余
⑤反应结束后生成的氢气质量相等。
(3)在AgNO3和Mg(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴入稀盐酸,有无色气体产生,则下列对滤渣和滤液的成分判断中,正确的是_____(填字母)。
A.滤液中溶质只有Fe(NO3)2 B.滤液中﹣定含有Fe(NO3)2和Mg(NO3)2
C. 滤渣中只有银 D.滤渣中一定含有银和铁
(4)科学家发现一种新金属。根据下表信息推测该金属不适合的用途是_____。
熔点 | 密度 | 强度 | 导电性 | 导热性 | 抗腐蚀性 |
2500℃ | 3g/cm3 | 与钢相似 | 良好 | 良好 | 优异 |
A.焊接金属 B.用于通讯设备 C.制造外科手术刀 D.制造航天飞机
(5)测定水中氢、氧元素的质量比。根据图3进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。
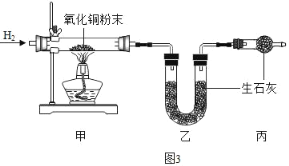
①水中氢、氧元素的质量比是_____(用含 a、b的式子表示)。
②下列因素中,对测定结果没有影响的是_____(填序号)。
A.CuO粉末不干燥 B.CuO没有完全转化为Cu C.没有丙装置