题目内容
【题目】实验室有一包碳酸钠和氯化钠及杂质的固体混合物样品(其中杂质不溶于水,也不与其他物质发生化学反应),兴趣小组的同学进行了如下实验:

(1)反应生成CO2的质量为_____g;
(2)计算原混合物中Na2CO3的质量分数为_____;
(3)计算 C 烧杯溶液中溶质的质量分数。_____(要求写出计算过程)
【答案】4.4 20% 25%
【解析】
(1)根据质量守恒定律可知,参加化学反应的物质,在化学反应前后的质量不变。所以减少的质量即为生成的二氧化碳的质量,即:50g+53g+50g-148.6g=4.4g。故答案为:4.4;
(2)设参加反应的碳酸钠的质量为x,生成的氯化钠的质量为y。

解得x=10.6g,y=11.7g
所以原混合物中碳酸钠的质量分数为:![]() =20%;
=20%;
(3)C烧杯中,溶液的质量为:148.6g-22.6g=126g。溶质为氯化钠,氯化钠的来源有两种,一种是碳酸钠和稀盐酸反应生成的氯化钠,另一种是原物质中的氯化钠。则原物质中的氯化钠的质量为:53g-10.6g-22.6g=19.8g。则溶质氯化钠的质量为:19.8g+11.7g=31.5g。则C烧杯中,溶质的质量分数为:![]() 。
。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
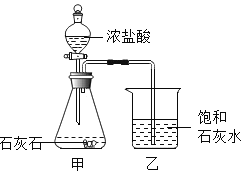
黄冈小状元同步计算天天练系列答案【题目】某化学兴趣小组在实验室做课外探究实验。如图所示,他们将一只烧杯罩在2支燃着的高低不同的蜡烛上,发现总是高的蜡烛先熄灭,请你随他们一起探究。
[提出问题]为什么高的蜡烛先熄灭?
[猜想假设]猜想1:__________________。
猜想2:上部的氧气被消耗。
[实验验证1]为了验证猜想1是否正确,小明同学进行了如下实验:
步骤 | 现象 | 结论 |
将浸有澄清石灰水的滤纸分别放在烧杯的顶部和底部,在滤纸上滴加酚酞溶液,变色后,用烧杯罩住点燃的高低蜡烛,观察高低滤纸褪色顺序。 | ____________________ | 烧杯上层二氧化碳浓度较高,高蜡烛先熄灭与二氧化碳浓度过高有关。涉及到的化学方程式是______________ |
[实验分析]小红对小明的结论表示怀疑,她用如图1装置收集一瓶80%二氧化碳与20%氧气的混合气体,最右边的仪器名称是____________;将燃着的短蜡烛自上而下缓慢伸入收集的混合气体瓶中,发现____________,从而证明小明的结论不正确。
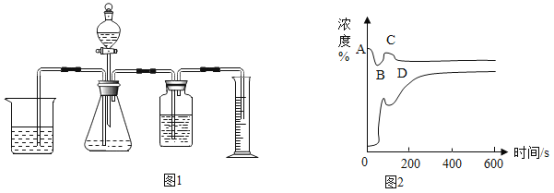
[实验验证2]为了验证猜想2,小红利用手持技术实验,用氧气、二氧化碳传感器在烧杯顶部测量烧杯内两支蜡烛从点燃到全部熄灭后,烧杯内氧气和二氧化碳的浓度变化,如图2所示。剩余氧气浓度15. 65%,二氧化碳浓度1. 898%。二氧化碳浓度增大不多,而氧气浓度明显下降。
[实验结论]____________________________________________。
[反思评价]根据图2中上面一条曲线(装置内氧气浓度)变化分析,在__________(填 “A”“B”“C”或“D” )点时蜡烛全部熄灭;请解释曲线AB段、BC段、CD段变化的原因。
AB段:_______________________________。
BC段:_______________________________。
CD段:_______________________________。