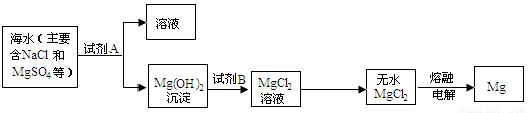
��Ŀ����
��2009?���������һ�������Դ���⣬���ǿ��ԴӺ�ˮ����ȡ�Ȼ��ƣ������Ȼ��ƺͱ�Ϊԭ���Ƶ��������ơ�������������Cl2��������ȡ����Ҫ�����������£�
��1�����÷紵��ɹ���ԴӺ�ˮ����ȡ���Σ��ù�����Ҫ�����仯��ѡ�����������ѧ������
��2��Ҫ��ȥʳ��ˮ�л�����������ɳ����ѡ��IJ��������ǣ�
��3������д���Ȼ����������е�һ����;��
��4���Ȼ��Ʊ�����Һ��ͨ�������·�����Ӧ�Ļ�ѧ����ʽ�ǣ���
���𰸡�������û�����������ɵı仯���������仯�����˿��Ѳ�����ˮ�����ʳ�ȥ�����ݷ�Ӧ��������P�������غ㶨�ɿ�����ȷ����д��ѧ����ʽ��
����⣺��1�����÷紵��ɹ���ԴӺ�ˮ����ȡ���Σ��ù�����Ҫ�����������仯�����������
��2��Ҫ��ȥʳ��ˮ�л�����������ɳ������ѡ��IJ��������ǹ��ˣ�������ˣ�
��3��ʳ���������п���������ζƷ���������ζƷ��
��4���Ȼ��Ʊ�����Һ��ͨ�������·�����Ӧ�Ļ�ѧ����ʽ�ǣ�2NaCl+2H2O 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����
�����������Ҫ���ջ�ѧ����ʽ����д�������˵ȷ����֪ʶ��ֻ���������ܶ���ط��������������ȷ���жϣ�
����⣺��1�����÷紵��ɹ���ԴӺ�ˮ����ȡ���Σ��ù�����Ҫ�����������仯�����������
��2��Ҫ��ȥʳ��ˮ�л�����������ɳ������ѡ��IJ��������ǹ��ˣ�������ˣ�
��3��ʳ���������п���������ζƷ���������ζƷ��
��4���Ȼ��Ʊ�����Һ��ͨ�������·�����Ӧ�Ļ�ѧ����ʽ�ǣ�2NaCl+2H2O
 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2���������������Ҫ���ջ�ѧ����ʽ����д�������˵ȷ����֪ʶ��ֻ���������ܶ���ط��������������ȷ���жϣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
23����2009?Ϋ���������Ǹ������Դ���⣬�����������������������������д����Ļ�ѧ���ʣ�
I����ˮ���壮�Ӻ�ˮ����ȡ����Լռ����������� ����ҵ�ϳ��á������������壬�乤���������£�
����ҵ�ϳ��á������������壬�乤���������£�

�Իش�
��1��������еĻ�ѧ����ʽΪ2NaBr+C12=2NaCl+Br2���䷴Ӧ������______��
��2���ǽ�������Ҳ�������ƽ���������Һ֮��ķ�Ӧ���ɣ�������Һ�пɷ������з�Ӧ��C12+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
�ɴ˿��ж�C12��I2��Br2�����ǿ����˳����______��
��ʳ���Ƽ�ҹ�������ѧ�Һ�°����������Ƽ����Ҫ�����ǣ�����Ũ��ˮ��ͨ�������Ķ�����̼����̼�������Һ����Ȼ������Һ�м���ʳ��ϸ����ֽ��裬�����������������ʵ����ʲ�ͬ�����߷�����Ӧ����̼�����ƣ����о����������۽�������̼�����Ƽ����Ƶ�̼���ơ�������̼��ˮ��
�������ڲ�ͬ�¶��µ��ܽ�ȱ���
��ش�
��1��̼����淋Ļ�ѧʽ��______��
��2�����ϱ��������̢����ܷ�����Ӧ��ԭ����______��
��3�����̢��з�Ӧ�Ļ�ѧ����ʽ��______ Na2CO3+CO2��+H2O
I����ˮ���壮�Ӻ�ˮ����ȡ����Լռ�����������
 ����ҵ�ϳ��á������������壬�乤���������£�
����ҵ�ϳ��á������������壬�乤���������£�
�Իش�
��1��������еĻ�ѧ����ʽΪ2NaBr+C12=2NaCl+Br2���䷴Ӧ������______��
��2���ǽ�������Ҳ�������ƽ���������Һ֮��ķ�Ӧ���ɣ�������Һ�пɷ������з�Ӧ��C12+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
�ɴ˿��ж�C12��I2��Br2�����ǿ����˳����______��
��ʳ���Ƽ�ҹ�������ѧ�Һ�°����������Ƽ����Ҫ�����ǣ�����Ũ��ˮ��ͨ�������Ķ�����̼����̼�������Һ����Ȼ������Һ�м���ʳ��ϸ����ֽ��裬�����������������ʵ����ʲ�ͬ�����߷�����Ӧ����̼�����ƣ����о����������۽�������̼�����Ƽ����Ƶ�̼���ơ�������̼��ˮ��
�������ڲ�ͬ�¶��µ��ܽ�ȱ���
| 10�� | 20�� | 30�� | 40�� | 50�� | |
| �Ȼ��� | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| ̼����� | 15.8 | 21.0 | 27.0 | ||
| ̼������ | 8.1 | 9.6 | 11.1 | 12.7 | |
| �Ȼ�� | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
��1��̼����淋Ļ�ѧʽ��______��
��2�����ϱ��������̢����ܷ�����Ӧ��ԭ����______��
��3�����̢��з�Ӧ�Ļ�ѧ����ʽ��______ Na2CO3+CO2��+H2O