题目内容
【题目】物质发生化学变化前后的总质量是否发生改变?是增加、减小还是不变呢?甲、乙、丙三位同学按下面的步骤进行探究。
(1)提出假设:物质发生化学变化前后的总质量不变。
(2)设计并进行实验,甲设计的实验装置和选用的药品如A图所示,乙设计的实验装置和选用的药品如B图所示,他们在反应前后都进行了规范的操作,准确地称量和细致地观察。
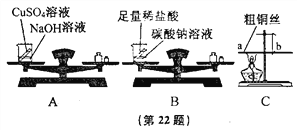
写出A、B两个实验发生反应的化学方程式:_______,_______。
丙进行了C图所示的实验,在一根用细铜丝吊着的长玻璃棒两端,分别绕上粗铜丝,并使玻璃保持水平。然后,用酒精灯给a端铜丝加热数分钟。停止加热后冷却,他观察到的现象是______________,______________。
(3)实验结论:
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等。
乙、丙认为:在化学反应中,生成物的总质量与反应物的总质量不相等。
(4)你认为_______的结论正确,请从原子的角度分析,结论正确的理由是_______。
(5)导致其他实验结论错误的原因是_______,_______。因此,如果_______的反应,则一定要设计反应在密闭装置中进行。
【答案】 CuSO4+2NaOH=Cu(OH)↓+Na2SO4 2HCl+Na2CO3=2NaCl+H2O+CO2↑ a端颜色变黑 a端下沉 甲 反应前后原子的种类、数目、质量均不变 B中有气体逸散到空气中 C中铜丝结合了空气中的氧 有气体参加或生成
【解析】分析:(2)根据反应物和复分解反应的原理书写化学方程式.铜在加热的条件下会与氧气反应生成氧化铜,会使铜丝质量增加.
(4)化学反应的过程实际上是原子的重新组合过程,原子的数目、质量、种类不会增减.
(5)在验证质量守恒定律时,若有气体参加或生成的实验必须在密闭的环境中进行.
解答:解:(2)根据反应物是氯化钡和硫酸钠及复分解反应的原理可知,生成物是硫酸钡和氯化钠,故答案为:
BaCl2+Na2SO4=BaSO4↓+2NaCl
根据反应物是碳酸钠和盐酸及复分解反应的原理可知,生成物是氯化钠、水和二氧化碳,故答案为:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
铜在加热的条件下会与氧气反应生成黑色的氧化铜,会使铜丝质量增加,会使左端下沉,故答案为:
a端上铜丝变黑;玻璃棒a端下沉
(4)化学反应的过程实际上是原子的重新组合过程,原子的数目、质量、种类不会增减,故答案为:
甲⑥在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变
(5)在验证质量守恒定律时,若有气体参加或生成的实验必须在密闭的环境中进行,生成物的质量等于参加的反应物的质量之和,故答案为:
B实验反应后生成的气体逸散到空气中去了
C实验a端铜丝增加了氧元素的质量
有气体参与反应或者生成物中有气体.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案