题目内容
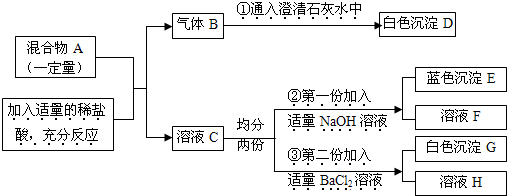
有一包固体混合物A,已知其中可能含有Na2CO3、Na2SO4、MgCl2、CuO四种物质中的两种或多种.按下图所示进行实验,观察到的现象图中所述:(设过程中所有发生的反应都恰好完全进行).
请根据上述实验过程和发生的现象做出合理判断,并填写下列空白:
(1)气体B是(填化学式)______.
(2)原固体粉末中一定不含有的物质是______.
(3)溶液F和H中都存在的金属阳离子为(写离子符号)______.
(4)写出③发生反应的化学方程式______,
该反应属于______(填“分解反应”“化合反应”“复分解反应”“置换反应”之一).
【答案】分析:根据气体B能使澄清的石灰水变浑浊,则B为二氧化碳,推出A中一定含碳酸钠,再根据反应③④和白色沉淀E、G,
E沉淀分别为Mg(OH)2,G沉淀为碳酸钡或硫酸钡或二者都有,推出A中可能有硫酸钠,一定有氯化镁,一定没有
氧化铜,则A的成分为一定有碳酸钠和氯化镁,可能有硫酸钠,一定没有氧化铜.
解答:解:由白色沉淀D、E、G和相关的反应,推出A的成分为一定有碳酸钠和氯化镁,可能有硫酸钠,一定没有氧化铜.
(1)因气体B能使澄清石灰水变浑浊,则B为二氧化碳,故选CO2.
(2)因反应③与碱反应得到白色沉淀,则溶液C中一定不含铜离子,A中不含氧化铜,故选CuO.
(3)因A中一定有碳酸钠和氯化镁,可能有硫酸钠,而镁离子转化为沉淀,根据元素守恒,溶液中一定
有Na+,故答案为:Na+.
(4)反应③是氯化镁和氢氧化钠的反应,碱与盐反应生成碱与盐的反应属于复分解反应,故答案为:
MgCl2+2NaOH=2NaCl+Mg(OH)2↓;复分解反应.
点评:本题推断的关键是利用好几种白色沉淀,然后根据元素守恒的方法来推导A中的固体成分,再进一步解答所提出的问题.
E沉淀分别为Mg(OH)2,G沉淀为碳酸钡或硫酸钡或二者都有,推出A中可能有硫酸钠,一定有氯化镁,一定没有
氧化铜,则A的成分为一定有碳酸钠和氯化镁,可能有硫酸钠,一定没有氧化铜.
解答:解:由白色沉淀D、E、G和相关的反应,推出A的成分为一定有碳酸钠和氯化镁,可能有硫酸钠,一定没有氧化铜.
(1)因气体B能使澄清石灰水变浑浊,则B为二氧化碳,故选CO2.
(2)因反应③与碱反应得到白色沉淀,则溶液C中一定不含铜离子,A中不含氧化铜,故选CuO.
(3)因A中一定有碳酸钠和氯化镁,可能有硫酸钠,而镁离子转化为沉淀,根据元素守恒,溶液中一定
有Na+,故答案为:Na+.
(4)反应③是氯化镁和氢氧化钠的反应,碱与盐反应生成碱与盐的反应属于复分解反应,故答案为:
MgCl2+2NaOH=2NaCl+Mg(OH)2↓;复分解反应.
点评:本题推断的关键是利用好几种白色沉淀,然后根据元素守恒的方法来推导A中的固体成分,再进一步解答所提出的问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目