题目内容
(2011?济南二模)有一包固体混合物A,已知其中可能含有Na2CO3、Na2SO4、MgCl2、CuO 四种物质中的两种或多种.按下图所示进行实验,出现的现象如图所述(设过程中所有发生的反应都恰好完全反应).
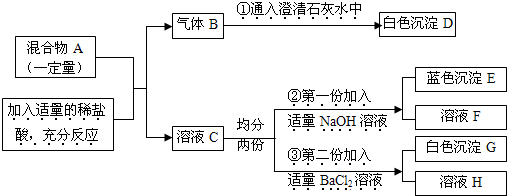
试根据实验过程和发生的现象做出合理判断,填写下列空白:
(1)气体B是(填化学式)
(2)原固体粉末中一定含有的物质是
(3)溶液F和溶液H中都存在的金属阳离子为(写离子符号)
(4)写出③中一定发生的反应的化学方程式

试根据实验过程和发生的现象做出合理判断,填写下列空白:
(1)气体B是(填化学式)
CO2
CO2
,蓝色沉淀E是(填化学式)Cu(OH)2
Cu(OH)2
.(2)原固体粉末中一定含有的物质是
Na2CO3、Na2SO4、CuO
Na2CO3、Na2SO4、CuO
.(3)溶液F和溶液H中都存在的金属阳离子为(写离子符号)
Na+
Na+
.(4)写出③中一定发生的反应的化学方程式
Na2SO4+BaCl2=BaSO4↓+2NaCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
.分析:(1)根据气体能使澄清石灰水变浑浊考虑气体,根据常见的蓝色沉淀考虑E的化学式;(2)根据加入盐酸产生二氧化碳说明含有碳酸盐,生成蓝色沉淀说明含有铜元素的物质,加入氯化钡产生沉淀,说明含有硫酸盐;(3)根据一定含有的物质与盐酸反应后的溶液中含有的溶质与氢氧化钠反应的生成物,与氯化钡反应的生成物考虑;(4)根据一定含有的物质与盐酸反应,生成物溶液中含有的溶质与氯化钡反应的方程式的书写方法考虑.
解答:解:(1)由二氧化碳能使澄清石灰水变浑浊,可知气体B是二氧化碳;氢氧化铜是蓝色沉淀,混合物中有氧化铜,所以加入氢氧化钠产生的蓝色沉淀是氢氧化铜;
(2)二氧化碳能使澄清石灰水变浑浊,可知气体B是二氧化碳,加入盐酸能生成二氧化碳,说明固体混合物中含有碳酸盐,所以混合物中含有碳酸钠;加入氢氧化钠得到蓝色沉淀,因为氢氧化铜是蓝色沉淀,所以混合物中必须含有铜元素,所以混合物中含有氧化铜;溶液C中加入氯化钡生成白色沉淀,与钡离子产生沉淀的是硫酸根离子,所以混合物中需要含有硫酸盐,即含有硫酸钠;
(3)碳酸钠与盐酸反应生成氯化钠、水、二氧化碳;氧化铜与盐酸反应生成氯化铜和水,所以溶液C中含有氯化钠、氯化铜和没反应的硫酸钠;氯化铜与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,所以溶液F中含有氯化钠;硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,所以溶液H中含有氯化钠;所以溶液F和溶液H中都存在的金属阳离子为Na+;
(4)反应物是硫酸钠和氯化钡,生成物是硫酸钡和氯化钠,用观察法配平,硫酸钡后面标上沉淀符号.
故答案为:(1)CO2;Cu(OH)2(2)Na2CO3、Na2SO4、CuO(3)Na+(4)Na2SO4+BaCl2=BaSO4↓+2NaCl
(2)二氧化碳能使澄清石灰水变浑浊,可知气体B是二氧化碳,加入盐酸能生成二氧化碳,说明固体混合物中含有碳酸盐,所以混合物中含有碳酸钠;加入氢氧化钠得到蓝色沉淀,因为氢氧化铜是蓝色沉淀,所以混合物中必须含有铜元素,所以混合物中含有氧化铜;溶液C中加入氯化钡生成白色沉淀,与钡离子产生沉淀的是硫酸根离子,所以混合物中需要含有硫酸盐,即含有硫酸钠;
(3)碳酸钠与盐酸反应生成氯化钠、水、二氧化碳;氧化铜与盐酸反应生成氯化铜和水,所以溶液C中含有氯化钠、氯化铜和没反应的硫酸钠;氯化铜与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,所以溶液F中含有氯化钠;硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,所以溶液H中含有氯化钠;所以溶液F和溶液H中都存在的金属阳离子为Na+;
(4)反应物是硫酸钠和氯化钡,生成物是硫酸钡和氯化钠,用观察法配平,硫酸钡后面标上沉淀符号.
故答案为:(1)CO2;Cu(OH)2(2)Na2CO3、Na2SO4、CuO(3)Na+(4)Na2SO4+BaCl2=BaSO4↓+2NaCl
点评:解答本题的突破口是要知道二氧化碳能使澄清石灰水变浑浊,碳酸盐能与盐酸反应生成二氧化碳,蓝色沉淀是氢氧化铜,与钡离子能产生白色沉淀的是硫酸根离子.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案
相关题目
 (2011?济南二模)对于下列常见元素的微粒结构示意图,有关说法正确的是( )
(2011?济南二模)对于下列常见元素的微粒结构示意图,有关说法正确的是( )