题目内容
【题目】工业上进行金属切割或焊接时常使用到氧炔焰(乙炔在氧气中燃烧产生的火焰)。
(1)化学反应常伴随有能量变化,乙炔燃烧是化学能转化为能;
(2)乙炔不充分燃烧,会产生和水,可见乙炔不充分燃烧既浪费燃料又污染环境,为了使乙炔充分燃烧,你的做法是;
(3)在点燃乙炔(C2H2)前,必须 , 以防止发生爆炸,请写出C2H2充分燃烧的化学方程式。
【答案】
(1)热
(2)一氧化碳;增大氧气的浓度
(3)检验纯度;2C2H2+5O2 ![]() 4CO2+2H2O
4CO2+2H2O
【解析】(1)乙炔燃烧是化学能转化为热能;(2)乙炔不充分燃烧,会生成一氧化碳和水,为了使乙炔充分燃烧,可以增大氧气的浓度;(3)可燃性气体不纯时点燃或加热会产生爆炸,故在点燃乙炔(C2H2)前,必须检验纯度,以防止发生爆炸,C2H2充分燃烧生成二氧化碳和水,发生反应的化学方程式为2C2H2+5O2 ![]() 4CO2+2H2O。
4CO2+2H2O。
故答案为:热;一氧化碳;增大氧气的浓度,检验纯度;2C2H2+5O2 ![]() 4CO2+2H2O。物质燃烧的条件有三个:氧气、可燃物、温度达到物质的着火点,三者缺一不可。由此可得到的灭火原理有:隔绝氧气、降低温度至着火点以下、隔离可燃物。任何可燃性气体在点燃之前斗眼检验纯度。
4CO2+2H2O。物质燃烧的条件有三个:氧气、可燃物、温度达到物质的着火点,三者缺一不可。由此可得到的灭火原理有:隔绝氧气、降低温度至着火点以下、隔离可燃物。任何可燃性气体在点燃之前斗眼检验纯度。

【题目】漂白粉的主要成分为次氯酸钙 [Ca(ClO)2] 和氯化钙,即可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是 [Ca(ClO)2] ,漂白的原理是:Ca(ClO)2在空气中发生反应。Ca(ClO)2+ CO2+ H2O=CaCO3↓+ 2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)HClO在常温下分解,反应为2HClO=2HCl+ O2↑。某瓶HClO溶液放置一段时间后,溶液的pH (填“增大”或“减小”或“不变”)。
(2)在漂白粉中滴加盐酸,能加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式。
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验。
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3。
(4)【实验探究】限选试剂及仪器,盐酸、石灰水、品红溶液、试管、带导管的单孔塞。
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中,。 | 有气体产生,气体使石灰水变浑浊。 | 猜想2成立 |
②在上述反应后试管中加少量。 | 。 |
(5)现有实验后的HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案: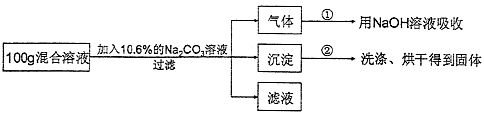
【实验数据】上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应后,共记录了两组实验数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
m= .
(6)上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为多少?.(不考虑过滤中的损失,计算结果保留到小数点后一位.)。