题目内容
金属在生产生活中应用广泛.
(1)铝可以制成铝箔,这是利用金属铝具有良好的 性.
(2)铁制品生锈的条件是 ,用稀盐酸除铁锈反应的化学方程式是 .
(3)我国是世界上最早采用湿法冶金提取铜的国家,铁与硫酸铜溶液反应的化学方程式是 .工业上冶炼铝,是将铝矿石(主要成分是Al2O3)在熔融条件下通电分解,其反应的化学方程式是 .
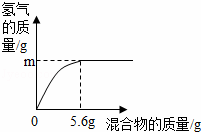
(4)现有两种金属单质组成的混合物.向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示.
下列说法正确的是 (填序号).
a.若混合物为Zn、Al,则m可能是0.2g
b.若混合物为Zn、Cu,则m一定大于0.2g
c.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3%
d.若混合物为Fe、Cu,m为0.1g,则该混合物中Fe的质量分数一定是50%
分析:
| (1)根据物质的性质决定其用途分析; (2)根据铁生锈的条件和用稀盐酸除锈的原理进行分析; (3)根据反应原理结合化学方程式的书写分析; (4)因为铝的相对原子质量比铁、锌都小,所以相同质量的铝与盐酸完全反应时,产生的氢气质量多. | |
| 解答: | 解:(1)金属铝具有良好的延展性,因此铝可以制成铝箔; (2)铁制品生锈的条件是与潮湿的空气接触;铁锈的主要成分是氧化铁,稀盐酸和氧化铁反应生成氯化铁和水,因此用稀盐酸除铁锈反应的化学方程式是Fe2O3+6HCl=2FeCl3+3H2O; (3)铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应的化学方程式是Fe+CuSO4=FeSO4+Cu;铝矿石(主要成分是Al2O3)在熔融条件下通电分解生成铝和氧气,其反应的化学方程式是2Al2O3 (4)若混合物全是铁,则铁的质量为5.6 g,则根据化学反应的方程式:Fe+2HCl=FeCl2+H2↑可计算出此时产生氢气的质量等于0.2 g,同理可计算出5.6 gAl与盐酸反应产生氢气的质量大于0.2 g,5.6g锌与盐酸反应产生氢气的质量小于0.2 g,铜和盐酸不反应. a、若混合物为Zn、Al,m可能等于0.2g,故a正确; b、若混合物为Zn、Cu,则m一定小于0.2g,故b错误; c、当混合物为Fe、Al时,因相同质量的铝消耗稀盐酸的质量比铁消耗盐酸的质量大,而5.6 g铁时,消耗盐酸的质量为7.3 g,所以混合物为Fe、Al时,消耗盐酸的质量大于7.3 g,根据质量分数公式可知所需盐酸溶质质量分数一定大于7.3%,故c正确; d、若混合物为Fe、Cu,m为0.1g,生成0.1g氢气需要铁的质量是2.8g,则混合物种铁的质量分数为 故答案为:(1)延展;(2)与潮湿的空气接触;Fe2O3+6HCl=2FeCl3+3H2O;(3)Fe+CuSO4=FeSO4+Cu;2Al2O3 |

 4Al+3O2↑;
4Al+3O2↑;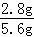 ×100%=50%,故d正确;
×100%=50%,故d正确;


 (2013?西城区一模)金属在生产生活中应用广泛.
(2013?西城区一模)金属在生产生活中应用广泛.