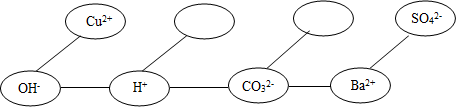
题目内容
请根据酸、碱、盐的相关知识,回答下列问题:
(1)用适量的稀硫酸除铁锈,其反应的化学方程式为______.
(2)胃液中含有适量的盐酸.治疗胃酸过多的药物有:细铁粉、氧化镁、氢氧化镁、碳酸氢钠等.用化学方程式表示细铁粉治疗胃酸过多的反应原理______,这几种药物治疗胃酸过多时所发生的反应中,属于复分解反应的有______个.
(3)铝制水壶内聚集了很多水垢,他找来稀盐酸,经短时间浸泡后,水垢全部除去.小雨没有长时间浸泡的原因是______,发生两个反应中,没有气泡产生的反应的化学方程式是______.
(4)发酵粉中的碳酸氢钠与有机酸(化学式用HX表示)反应,使蒸出的馒头有许多小孔.其反应的化学方程式为______.
(5)用水鉴别NaOH、NaCl、CaCO3三种固体物质时,能够鉴别出NaOH固体所依据的现象是______.
(6)探究稀盐酸、Na2CO3溶液、Ca(OH)2溶液之间能否发生化学反应时,将所有废液倒入同一洁净烧杯中.除指示剂外,最终烧杯中一定含有的一种溶质是______.
解:(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)铁与盐酸反应的化学式是:Fe+2HCl═FeCl2+H2↑;氧化镁与盐酸反应的化学式是:MgO+HCl═MgCl2+H2O;氢氧化镁与盐酸反应的化学式是:Mg(OH)2+2HCl═MgCl2+2H2O;碳酸氢钠与盐酸反应的化学式是:NaHCO3+HCl═NaCl+H2O+CO2↑,根据复分解反应的定义和条件可知符合复分解反应的有三个;
(3)水垢[主要成分:CaCO3、Mg (OH)2],与稀盐酸反应没有气泡产生的反应,应是稀盐酸与Mg (OH)2的反应,化学反应式是:
Mg(OH)2+2HCl═MgCl2+2H2O;由于金属铝是活泼金属,能与稀盐酸反应,因此除水垢时盐酸不能过量,否则过量的盐酸就和铝壶反应;
(4)碳酸氢钠属于盐,HX是酸,又因酸与盐反应生成另外一种酸和另一种盐,以及馒头有许多小孔是因为有二氧化碳气体的生成,所以化学反应式是:
NaHCO3+HX═NaX+H2O+CO2↑;
(5)NaOH、NaCl、CaCO3三种固体物质中,CaCO3不溶于水,NaOH、NaCl都溶于水,但NaOH溶于水要释放出热量,但NaCl溶于水不没有明显的温度变化,所以可以区分;
(6)稀盐酸、Na2CO3溶液、Ca(OH)2溶液之间能否发生化学反应,碳酸钠与氢氧化钙生成碳酸钙沉淀,同时生成氢氧化钠;而生成的氢氧化钠又可与稀盐酸发生中和反应,生成氯化钠和水;氯化钠不与题中其它物质发生反应,所以最终烧杯中一定含有反应最终生成的氯化钠溶质.
故答案为:(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(2)Fe+2HCl═FeCl2+H2↑;三
(3)防止盐酸与铝壶发生反应;Mg(OH)2+2HCl═MgCl2+2H2O
(4)NaHCO3+HX═NaX+H2O+CO2↑
(5)能溶解于水,且放热
(6)NaCl
分析:(1)用适量的稀硫酸可以除去铁锈:反应物为铁锈的主要成分氧化铁和硫酸,反应符合复分解反应的特点,则可知生成物为硫酸铁和水;
(2)根据胃液中的盐酸可以与铁反应考虑;根据化学反应式和复分解反应发生的条件判断;
(3)根据水垢的两种主要成分与稀盐酸的反应判断;根据铝也可以与稀盐酸反应考虑;
(4)根据酸与盐反应生成另外一种酸和另一种盐,以及馒头有许多小孔是因为有二氧化碳气体的生成考虑;
(4)分析三种物质间发生的反应,判断最终溶液中一定含有的物质,该物质应能溶于水且不与题中物质发生反应;
(6)根据三种物质的水溶性和溶于水后的现象考虑.
点评:本题量大,考查内容多为化学方程式的书写、文字表达且全面,但都是基础知识,所以同学们一定要学会课本基础知识,以不变应万变.
(2)铁与盐酸反应的化学式是:Fe+2HCl═FeCl2+H2↑;氧化镁与盐酸反应的化学式是:MgO+HCl═MgCl2+H2O;氢氧化镁与盐酸反应的化学式是:Mg(OH)2+2HCl═MgCl2+2H2O;碳酸氢钠与盐酸反应的化学式是:NaHCO3+HCl═NaCl+H2O+CO2↑,根据复分解反应的定义和条件可知符合复分解反应的有三个;
(3)水垢[主要成分:CaCO3、Mg (OH)2],与稀盐酸反应没有气泡产生的反应,应是稀盐酸与Mg (OH)2的反应,化学反应式是:
Mg(OH)2+2HCl═MgCl2+2H2O;由于金属铝是活泼金属,能与稀盐酸反应,因此除水垢时盐酸不能过量,否则过量的盐酸就和铝壶反应;
(4)碳酸氢钠属于盐,HX是酸,又因酸与盐反应生成另外一种酸和另一种盐,以及馒头有许多小孔是因为有二氧化碳气体的生成,所以化学反应式是:
NaHCO3+HX═NaX+H2O+CO2↑;
(5)NaOH、NaCl、CaCO3三种固体物质中,CaCO3不溶于水,NaOH、NaCl都溶于水,但NaOH溶于水要释放出热量,但NaCl溶于水不没有明显的温度变化,所以可以区分;
(6)稀盐酸、Na2CO3溶液、Ca(OH)2溶液之间能否发生化学反应,碳酸钠与氢氧化钙生成碳酸钙沉淀,同时生成氢氧化钠;而生成的氢氧化钠又可与稀盐酸发生中和反应,生成氯化钠和水;氯化钠不与题中其它物质发生反应,所以最终烧杯中一定含有反应最终生成的氯化钠溶质.
故答案为:(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(2)Fe+2HCl═FeCl2+H2↑;三
(3)防止盐酸与铝壶发生反应;Mg(OH)2+2HCl═MgCl2+2H2O
(4)NaHCO3+HX═NaX+H2O+CO2↑
(5)能溶解于水,且放热
(6)NaCl
分析:(1)用适量的稀硫酸可以除去铁锈:反应物为铁锈的主要成分氧化铁和硫酸,反应符合复分解反应的特点,则可知生成物为硫酸铁和水;
(2)根据胃液中的盐酸可以与铁反应考虑;根据化学反应式和复分解反应发生的条件判断;
(3)根据水垢的两种主要成分与稀盐酸的反应判断;根据铝也可以与稀盐酸反应考虑;
(4)根据酸与盐反应生成另外一种酸和另一种盐,以及馒头有许多小孔是因为有二氧化碳气体的生成考虑;
(4)分析三种物质间发生的反应,判断最终溶液中一定含有的物质,该物质应能溶于水且不与题中物质发生反应;
(6)根据三种物质的水溶性和溶于水后的现象考虑.
点评:本题量大,考查内容多为化学方程式的书写、文字表达且全面,但都是基础知识,所以同学们一定要学会课本基础知识,以不变应万变.

练习册系列答案
相关题目
某中学同学学完第十一单元后,在教师的指导下对“酸、碱、盐之间并不是都能发生复分解反应,发生复分解反应应具备哪些条件?”设计了如下科学探究活动.
(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生.
(3)进行实验并观察实验现象,请结合实验完成下表:
(4)解释与结论:
上述反应为什么能够发生?是因为在这些反应物中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如①中有Ba2++SO42-→BaSO4↓,②中有H++CO32-→H2O+CO2↑,③中有H++OH-→H2O,④中有 ,⑤中有 ,从而使化学反应得以发生.经过分析,同学们得出的结论,猜想 正确.
(5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络.在网络中,用“---”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水.现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“ ”内,使其形成一个更完整的复分解反应的知识网络.
”内,使其形成一个更完整的复分解反应的知识网络.
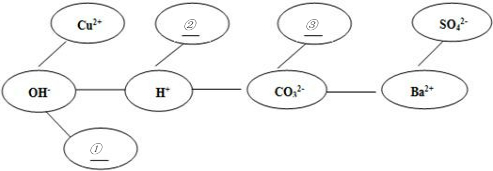
(6)拓展应用:根据得出的结论,解决以下问题:
t℃时四种化合物在溶剂A和溶剂B的溶解度如下表:
t℃时表中四种化合物在溶剂A中发生复分解反应的化学方程式为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2,则表中四种化合物中某两种化合物在溶剂B中发生复分解反应的化学方程式为 .
(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生.
(3)进行实验并观察实验现象,请结合实验完成下表:
| 实验步骤 | 实验现象 | 化学反应方程式 |
| ①硝酸钡溶液中滴加稀硫酸 | H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 | |
| ②稀硫酸溶液中滴加碳酸钾溶液 | H2SO4+K2CO3=K2SO4+CO2↑+H2O | |
| ③稀盐酸溶液中先加2滴酚酞试液再滴加氢氧化钠溶液 | 溶液由无色变浅红色,并不褪色 | |
| ④硝酸钡溶液中滴加碳酸钾溶液 | 有白色沉淀 | |
| ⑤氯化铵溶液中滴加浓氢氧化钠溶液后加热,并用湿的红石蕊试纸检验生成的气体 | 有无色、刺激性气味的气体生成,该气体能使湿的红石蕊试纸变蓝 |
上述反应为什么能够发生?是因为在这些反应物中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如①中有Ba2++SO42-→BaSO4↓,②中有H++CO32-→H2O+CO2↑,③中有H++OH-→H2O,④中有
(5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络.在网络中,用“---”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水.现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“
 ”内,使其形成一个更完整的复分解反应的知识网络.
”内,使其形成一个更完整的复分解反应的知识网络.
(6)拓展应用:根据得出的结论,解决以下问题:
t℃时四种化合物在溶剂A和溶剂B的溶解度如下表:
| 物质 | 在溶剂A中的溶解度/g | 在溶剂B中的溶解度/g |
| AgNO3 | 170 | 86 |
| Ba(NO3)2 | 9.3 | 97.2 |
| AgCl | 1.5×10-4 | 0.8 |
| BaCl2 | 33.3 | 约为0 |
(10分)某中学同学学完第十一单元后,在教师的指导下对“酸、碱、盐之间并不是都能发生复分解反应,发生复分解反应应具备哪些条件?”设计了如下科学探究活动。
(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生。
(3)进行实验并观察实验现象,请结合实验完成下表:
| 实验步骤 | 实验现象 | 化学反应方程式 |
| ①硝酸钡溶液中滴加稀硫酸 | ▲ | H2SO4 + Ba(NO3)2 = BaSO4↓+ 2 HNO3 |
| ②稀硫酸溶液中滴加碳酸钾溶液 | ▲ | H2SO4+ K2CO3 = K2SO4+ CO2↑+H2O |
| ③稀盐酸溶液中先加2滴酚酞试液再滴加氢氧化钠溶液 | 溶液由无色变浅红色,并不褪色 | ▲ |
| ④硝酸钡溶液中滴加碳酸钾溶液 | 有白色沉淀 | ▲ |
| ⑤氯化铵溶液中滴加浓氢氧化钠溶液后加热,并用湿的红石蕊试纸检验生成的气体 | 有无色、刺激性气味的气体生成,该气体能使湿的红石蕊试纸变蓝 | ▲ |
上述反应为什么能够发生?是因为在这些反应物中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水。如①中有Ba2++SO42- →BaSO4↓,②中有H+ + CO32- → H2O + CO2↑,③中有H+ + OH- → H2O,④中有 ▲ ,⑤中有 ▲ ,从而使化学反应得以发生。
经过分析,同学们得出的结论,猜想 ▲ 正确。
 (5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络。在网络中,用“———”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水。现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“ ”内,使其形成一个更完整的复分解反应的知识网络。
(5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络。在网络中,用“———”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水。现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“ ”内,使其形成一个更完整的复分解反应的知识网络。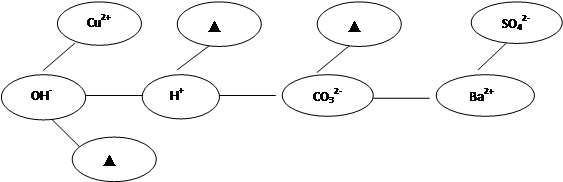 |
(6)拓展应用:根据得出的结论,解决以下问题:
t℃时四种化合物在溶剂A和溶剂B的溶解度如下表:
| 物质 | 在溶剂A中的溶解度/g | 在溶剂B中的溶解度/g |
| AgNO3 | 170 | 86 |
| Ba(NO3)2 | 9.3 | 97.2 |
| AgCl | 1.5×10-4 | 0.8 |
| BaCl2 | 33.3 | 约为0 |
为 ▲ 。
某中学同学学完第十一单元后,在教师的指导下对“酸、碱、盐之间并不是都能发生复分解反应,发生复分解反应应具备哪些条件?”设计了如下科学探究活动.
(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生.
(3)进行实验并观察实验现象,请结合实验完成下表:
| 实验步骤 | 实验现象 | 化学反应方程式 |
| ①硝酸钡溶液中滴加稀硫酸 | ______ | H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 |
| ②稀硫酸溶液中滴加碳酸钾溶液 | ______ | H2SO4+K2CO3=K2SO4+CO2↑+H2O |
| ③稀盐酸溶液中先加2滴酚酞试液再滴加氢氧化钠溶液 | 溶液由无色变浅红色,并不褪色 | ______ |
| ④硝酸钡溶液中滴加碳酸钾溶液 | 有白色沉淀 | ______ |
| ⑤氯化铵溶液中滴加浓氢氧化钠溶液后加热,并用湿的红石蕊试纸检验生成的气体 | 有无色、刺激性气味的气体生成,该气体能使湿的红石蕊试纸变蓝 | ______ |
上述反应为什么能够发生?是因为在这些反应物中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如①中有Ba2++SO42-→BaSO4↓,②中有H++CO32-→H2O+CO2↑,③中有H++OH-→H2O,④中有______,⑤中有______,从而使化学反应得以发生.经过分析,同学们得出的结论,猜想______正确.
(5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络.在网络中,用“---”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水.现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“
 ”内,使其形成一个更完整的复分解反应的知识网络.
”内,使其形成一个更完整的复分解反应的知识网络.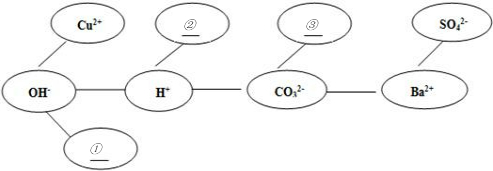
(6)拓展应用:根据得出的结论,解决以下问题:
t℃时四种化合物在溶剂A和溶剂B的溶解度如下表:
| 物质 | 在溶剂A中的溶解度/g | 在溶剂B中的溶解度/g |
| AgNO3 | 170 | 86 |
| Ba(NO3)2 | 9.3 | 97.2 |
| AgCl | 1.5×10-4 | 0.8 |
| BaCl2 | 33.3 | 约为0 |
某校化学兴趣小组的同学学习了酸、碱、盐的知识后,对课本中“酸、碱、盐之间并不是都能发生复分解反应”这句话产生了兴趣,展开了探究性学习.
(1)【提出问题】发生复分解反应应具备哪些条件?
(2)【活动探究】该小组同学进行以下四组实验,发现均能反应,写出反应④的化学方程式:
①硝酸钡溶液与稀硫酸 ②稀硫酸与碳酸钾溶液 ③稀盐酸与氢氧化钠溶液 ④硝酸钡溶液与碳酸钾溶液:______.
(3)【理论分析】上述反应未什么能够发生?是因为在这些反应物的溶液中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如:
①中有Ba2++SO42-→BaSO4↓ ②中有H++CO32-→H2O+CO2↑ ③中有H++OH-→H2O ④中有______两种离子,所以才发生化学反应.
(4)【得出结论】经过分析,该小组同学得出以下结论:生成物中是否有沉淀或气体或水,是判断酸、碱、盐之间能否发生复分解反应的主要条件.
(5)【形成网络】按照一定的顺序排列某些离子,就可以形成一种知识网络.在网络中,用“--”相连接的阴、阳离子间能两两结合生成沉淀或气体或水.现有Ca2+、HCO3-两种离子,请将它们填入下面合适的“ ”内,使其形成一个更为完整的复分解反应的知识网络.
”内,使其形成一个更为完整的复分解反应的知识网络.
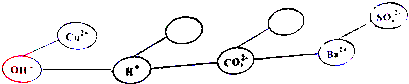
(6)【拓展应用】根据得出的结论,解决以下问题:
已知t℃时四种化合物在溶剂A和溶剂B中各自的溶解度(g/100g溶剂)如下表所示.
| 物质 | 在溶剂A中的溶解度 | 在溶剂B中的溶解度 |
| AgNO3 | 170 | 86 |
| Ba(NO3)2 | 9.3 | 97.2 |
| AgCl | 1.5×10-4 | 0.8 |
| BaCl2 | 33.3 | 约为0 |
则表中四种化合物中某两种化合物在溶剂B中能发生复分解反应的化学方程式为:______.
 ”内,使其形成一个更为完整的复分解反应的知识网络.
”内,使其形成一个更为完整的复分解反应的知识网络.