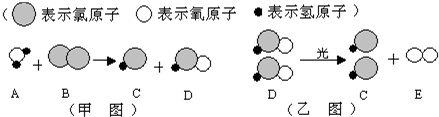
题目内容
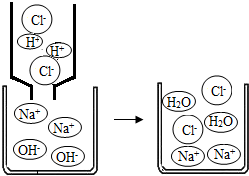 如图,表示盐酸和氢氧化钠溶液反应的微观过程.根据图示回答下列问题:
如图,表示盐酸和氢氧化钠溶液反应的微观过程.根据图示回答下列问题:
(1)盐酸中含有的离子有________(填离子符号).
(2)氢氧化钠溶液显碱性的原因是因为该溶液中含有________.
(3)从粒子的角度具体分析该反应能发生的原因是________.
解:(1)盐酸溶液中存在的微粒有H+、Cl-、H2O等微粒
故答案为:H+、Cl-
(2)溶液显碱性是因为溶液中存在OH-
故答案为:OH-
(3)在中和反应中钠离子和氯离子没有改变,改变是氢氧根离子和氢离子
故答案为:H++OH-=H2O
分析:盐酸中含有的离子为氢离子和氯离子,而溶液显碱性的原因是因为溶液中含有氢氧根离子.中和反应的实质是H++OH-=H2O
点评:了解中和反应的实质,是离子结合成沉淀或气体或水的过程.溶液中溶质在水分子的作用下都是以离子的形式存在.
故答案为:H+、Cl-
(2)溶液显碱性是因为溶液中存在OH-
故答案为:OH-
(3)在中和反应中钠离子和氯离子没有改变,改变是氢氧根离子和氢离子
故答案为:H++OH-=H2O
分析:盐酸中含有的离子为氢离子和氯离子,而溶液显碱性的原因是因为溶液中含有氢氧根离子.中和反应的实质是H++OH-=H2O
点评:了解中和反应的实质,是离子结合成沉淀或气体或水的过程.溶液中溶质在水分子的作用下都是以离子的形式存在.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
用如图所示装置,连成一套测定水的组成的装置(实验时B中装入锌粒和稀盐酸).请回答以下问题:
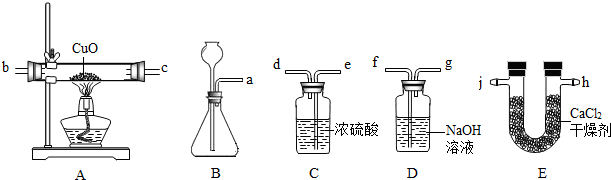
(1)检查B装置气密性的方法是 .
(2)除本实验外,B装置还可用来制取的气体是 .
(3)已知实验装置的连接顺序可用字母a~i表示a f g e d b c (或c b)i,则C装置的作用是 ,D装置的作用是 .
(4)A装置中发生反应的化学方程式为 .
(5)实验结果如下表
用上表数据列出求水中氧元素与氢元素质量比的计算式: .
如果酒精灯熄灭后立即停止通氢气,则所得出的水中氢、氧元素质量之比将 (填“偏高”、“偏低”或“不变”).

(1)检查B装置气密性的方法是
(2)除本实验外,B装置还可用来制取的气体是
(3)已知实验装置的连接顺序可用字母a~i表示a f g e d b c (或c b)i,则C装置的作用是
(4)A装置中发生反应的化学方程式为
(5)实验结果如下表
| 项目 | 实验前 | 实验后 |
| 氧化铜+玻璃管 | 65.6g | 59.2g |
| 氯化钙+U形管 | 100.8g | 108.0g |
如果酒精灯熄灭后立即停止通氢气,则所得出的水中氢、氧元素质量之比将
用如图所示装置,连成一套测定水的组成的装置(实验时B中装入锌粒和稀盐酸).请回答以下问题:

(1)检查B装置气密性的方法是______.
(2)除本实验外,B装置还可用来制取的气体是______.
(3)已知实验装置的连接顺序可用字母a~i表示a f g e d b c (或c b)i,则C装置的作用是______,D装置的作用是______.
(4)A装置中发生反应的化学方程式为______.
(5)实验结果如下表
用上表数据列出求水中氧元素与氢元素质量比的计算式:______.
如果酒精灯熄灭后立即停止通氢气,则所得出的水中氢、氧元素质量之比将______(填“偏高”、“偏低”或“不变”).

(1)检查B装置气密性的方法是______.
(2)除本实验外,B装置还可用来制取的气体是______.
(3)已知实验装置的连接顺序可用字母a~i表示a f g e d b c (或c b)i,则C装置的作用是______,D装置的作用是______.
(4)A装置中发生反应的化学方程式为______.
(5)实验结果如下表
| 项目 | 实验前 | 实验后 |
| 氧化铜+玻璃管 | 65.6g | 59.2g |
| 氯化钙+U形管 | 100.8g | 108.0g |
如果酒精灯熄灭后立即停止通氢气,则所得出的水中氢、氧元素质量之比将______(填“偏高”、“偏低”或“不变”).