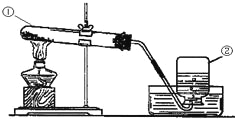
题目内容
【题目】密闭容器中,4.6 g 乙醇与 8.0 g O2 恰好完全反应,生成 5.4 g H2O、4.4 g CO2 和物质 X,则生成物中 H2O 与 X 的分子个数比为_____,若要使 X 充分燃烧,则一开始需加入的 O2 的质量为_____
【答案】3:19.6 g
【解析】
据质量守恒定律可知,反应前后物质的总质量、元素的种类不变。生成物X为一氧化碳,质量为4.6 g +8.0 g -5.4 g-4.4 g=2.8g;所以生成水和一氧化碳的分子个数比为:![]() =3:1;2CO+O2
=3:1;2CO+O2![]() 2CO2,一氧化碳和氧气的质量比为56:32,故使2.8g氧气完全燃烧需要氧气的质量为1.6g,则一开始需加入的 O2 的质量为8g+1.6g=9.6g。
2CO2,一氧化碳和氧气的质量比为56:32,故使2.8g氧气完全燃烧需要氧气的质量为1.6g,则一开始需加入的 O2 的质量为8g+1.6g=9.6g。

练习册系列答案
相关题目
【题目】下列对一些事实解释不正确的是( )
事实 | 解释 | |
| 二氧化碳无毒,而一氧化碳有毒 | 物质组成元素不同,分子结构也不同 |
|
| 海水中溶解的盐,使其凝固点降低 |
| 蒸发水和电解水是两种不同类型的变化 | 变化中,前者没有新物质生成,后者有新物质生成 |
| 溶液和溶液的颜色不同 | 两种溶液中的阴离子不同 |
A. A B. B C. C D. D