题目内容
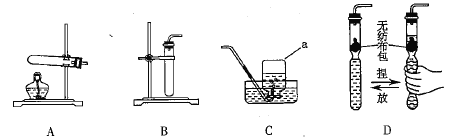
【题目】过氧化钙(CaO2)是一种重要的化工产品,可用来改善地表水质、治理赤潮,过氧化钙产品中常含有氧化钙杂质,以下是某学习小组为测定过氧化钙产品纯度设计的实验,实验装置如图;已知:CaO2是一种白色粉末,微溶于水,易溶于稀盐酸,且发生反应: CaO2+2HCl=CaCl2+H2O2

实验步骤:实验前称取产品及二氧化锰共12克,先缓慢通入氮气,一段时间后,加热铜网至红热,再缓慢滴入过量稀盐酸,直至A中样品完全反应。继续缓慢通入氮气,一段时间后停止加热,待C中铜网冷却后,停止通入氮气,将锥形瓶中的剩余物过滤,洗涤,干燥,得到滤渣2.0克。回答下列问题,
(1)二氧化锰与稀盐酸不反应,A中二氧化锰的作用是______________
(2)样品完全反应后,继续缓慢通入氮气的目的是______________
(3)装置B的作用有,除去气体中的水蒸气、______________
(4)实验测得C装置中铜网增重1.8克,该产品中过氧化钙的质量分数为_____________
【答案】使生成的过氧化氢催化分解 使生成的氧气全部与铜反应,防止空气中的氧气与热的铜网反应 可通过气泡产生的速率来控制气流速度 81%
【解析】
(1)由于稀盐酸与过氧化钙反应生成氯化钙和过氧化氢,而二氧化锰与稀盐酸不反应,故A中二氧化锰的作用是:使生成的过氧化氢催化分解;
(2)样品完全反应后,继续缓慢通入氮气的目的是:使生成的氧气全部与铜反应,防止空气中的氧气与热的铜网反应;
(3)装置B的作用有,除去气体中的水蒸气、可通过气泡产生的速率来控制气流速度;
(4)C装置中铜网与反应生成的氧气反应生成氧化铜。C装置中铜网增重的质量即为反应生成的氧气的质量。
设生成1.8g氧气需要过氧化氢的质量为x。
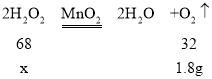
![]()
x=3.825g
设过氧化钙的质量为y。
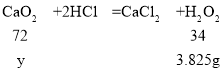
![]()
y=8.1g
故该产品中过氧化钙的质量分数为:![]() ×100%=81%。
×100%=81%。

【题目】长期使用的热水锅炉会产生水垢。水垢主要成分是碳酸钙和氢氧化镁。某兴趣小组为了测定水垢中CaCO3的含量,将6g水垢粉碎放在烧杯中,然后向其中加入40g某浓度的稀盐酸,使之充分反应(水垢中除碳酸钙和氢氧化镁外都不与稀盐酸反应)。实验数据记录如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
烧杯内所盛物 质的总质量/g | 46.0 | 45.2 | 44.8 | 45.1 | 44.1 | 43.9 | 43.8 | 43.8 | 43.8 |
试计算:(1)表中有一数据是不合理的,该数据的测得时间是第_____min;
(2)水垢中CaCO3的质量分数_____(计算结果精确至0.1%)。
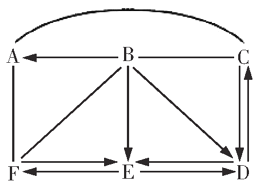
【题目】现有A~F六种稀溶液,分别是碳酸钠溶液、氢氧化钠溶液、氢氧化钙溶液、稀盐酸、氯化钠溶液、酚酞溶液中的一种,把他们两两混合,其部分现象如下表所示。
B | C | D | E | |
A | 无明显变化 | 白色沉淀 | 无明显变化 | 液体变红色 |
B | 气体逸出 | 无明显变化 | 无明显变化 |
(1)①B、E中的溶液分别是______、______。
②A与C中发生反应的化学方程式为______。
(2)对还没有确定的稀溶液,下列鉴别方法中错误的是______(填序号)。
①分别蒸发溶剂 ②分别滴加适量水 ③分别滴加FeCl3溶液 ④分别测定pH ⑤分别通入CO2后,再滴加稀盐酸
(3)相同质量、相同溶质质量分数的氢氧化钾溶液与盐酸相混合后,滴加紫色石蕊溶液,溶液呈______色。