题目内容
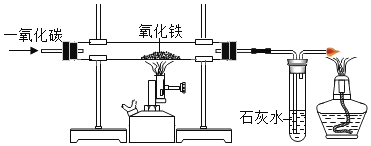
【题目】A~I是初中化学常见的物质,他们之间的相互关系如下图所示,(“→”指向生成物。)其中B是红色粉末,A、C常温下是气体,H和I由三种元素组成,H不溶于稀硝酸, I是红褐色沉淀。请回答下面问题:

(1)物质I的化学式是_____; 物质E的化学式是_____。
(2)反应②的基本反应类型是_____ 。
(3)物质F属于_____(填“酸”、“碱”、“盐”或“氧化物”)。
(4)物质C的一种用途_____。
(5)反应①的化学方程式为_____。
【答案】Fe(OH)3 H2SO4 复分解反应 碱 灭火或人工降雨等(合理即可) Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
【解析】
A~I是初中化学常见的物质,B是红色粉末,A、C常温下是气体,A、B高温会生成C、D,所以B是氧化铁,A是一氧化碳,一氧化碳和氧化铁高温会生成铁和二氧化碳,所以C就是二氧化碳,D是铁,氧化铁和E会生成G,所以E是酸,H和I中含有一种相同元素,H不溶于稀硝酸,所以H是氯化银或硫酸钡,H和I中含有一种相同元素,所以含有的相同的元素是氧元素,则H是硫酸钡,I是氢氧化铁,G是硫酸铁,F是氢氧化钡,经过验证,推导正确。
由分析可知(1)I是Fe(OH)3,E是H2SO4;
(2)通过推导可知,反应②氧化铁和稀硫酸反应生成硫酸铁和水的反应,该反应属于复分解反应;
(3)通过推导可知,F是氢氧化钡,属于碱类物质;
(4)物质C是①的反应生成的二氧化碳,二氧化碳不能支持燃烧,所以可以用来灭火;
(5)反应①是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳的反应,化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】溶解度是我们初中化学常见的概念,请回答下列问题。
I.下表是NaC1、KNO3在不同温度下的溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | |
(1)要比较NaC1、KNO3在水中的溶解能力,需要控制的变量是水的质量和_____________________。
(2)从KNO3溶液中获取其晶体适宜的方法是_____________________。
(3)20℃时,各取NaC1、KNO3固体3.5g加入10g水中,充分溶解后达到饱和状态的是___溶液。
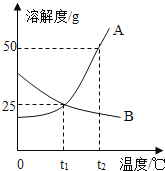
(4)若将上述数据在坐标中绘制成NaCl、KNO3的溶解度曲线,两条曲线的交,点对应的温度范围是(_____)
A 0°C~20°C
B 20°C ~40°C
C 40°C ~60°C
D 60°C ~80°C
II.将质量为30g的B物质加入到50g水中,充分搅拌后,剩余物质的质量随温度的关系如图所示,过程中不考虑水分蒸发,回答问题:
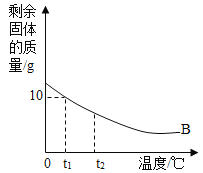
(5)固体B的溶解度随温度的升高而____________(填“增大”或“减小”) 。
(6) t1℃时,B的溶解度是___________。
【题目】分类、类比、推理都是学习化学常用的方法。
(1)物质的性质很大程度上决定了物质的用途,熟知物质的性质才能更好的应用物质,下图为初中化学教材中的实验。请回答问题:
A组 | B组 | 实验C | ||
石墨导电实验 |
二氧化碳的溶解性实验 |
氢气燃烧 |
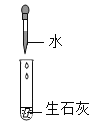
生石灰中加入水 |
酸或碱的溶液改变花的颜色 |
若按照研究物质性质的角度进行分类,应将实验C归为_____组,理由是_____;
(2)通过课外阅读发现有下列反应:
Cl2+2NaBr=2NaCl+Br2 Br2+2KI=2KBr+I2
Cl2 Br2 I2 是氯、溴、碘三种元素组成的三种非金属单质。经过类比分析,发现非金属单质与盐发生的置换反应跟金属与盐发生的置换反应有类似的规律。因此可以判断Cl2 Br2 I2 三种非金属中活泼性最强的是_____(写化学式)。
查阅资料又得知结论:硫的活泼性比上述三种单质的活泼性都弱。请仿照上述反应,用硫元素和钾元素组成的化合物与其发生的一个反应来证明此结论(用化学方程式回答)_____。