题目内容
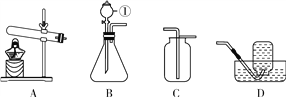
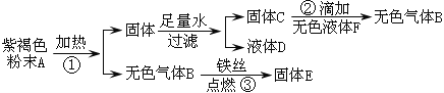
【题目】某兴趣小组为了区分氢氧化钠溶液和氢氧化钙溶液,设计了如下图所示的四组实验方案,请按要求回答问题.

(1)上述实验方案中能达到实验目的是_______(填字母序号).
(2)C组实验中发生反应的化学方程式为___________________________.
【继续探究】实验结束后,小组的同学将A、B、C、D四组实验八支试管中的物质倒入同一个烧杯中,最终得到无色透明的溶液.
【分析讨论】
①烧杯中能跟稀盐酸发生化学反应的物质有_______种(酚酞除外).
②最终得到的溶液中:一定含有的溶质是_____________(填化学式,下同),一定不含有的溶质是________,可能含有的溶质是_______.
【实验验证】为了验证最终得到的溶液中可能含有的溶质是否存在,小组的同学取少量烧杯中的溶液于试管中,向其中逐滴加入碳酸钠溶液直至过量,观察到________,证明含有该溶质.
【拓展延伸】小组的同学把D组实验方案中的二氧化碳换成二氧化硫,达到同样实验效果.二氧化硫跟氢氧化钙反应的化学方程式为______________________.
【答案】 C、D Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 4 NaCl、CaCl2 Ca(OH)2、NaOH、Na2CO3 HCl 有气泡产生 SO2+Ca(OH)2═CaSO3↓+H2O
【解析】(1)根据氢氧化钠和氢氧化钙的性质可以知道,它们都能够和稀盐酸反应且都没有现象,都能使酚酞变红,氢氧化钠不能和碳酸钠反应,但是氢氧化钙可以和碳酸钠反应生成白色沉淀,氢氧化钠和氢氧化钙都能二氧化碳反应,但是氢氧化钠反应没有现象,和氢氧化钙反应生成白色沉淀,所以能够实现目的实验为C和D;
(2)C组中发生的反应为氢氧化钙和碳酸钠的反应,该反应生成了碳酸钙沉淀和氢氧化钠,该反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
【分析讨论】实验结束后,小组的同学将A、B、C、D四组实验八支试管中的物质倒入同一个烧杯中,最终得到无色透明的溶液。说明溶液中无碳酸钙、无碱性物质,A中盐酸有剩余,盐酸与碳酸钙反应,生成氯化钙、水和二氧化碳;氢氧化钠与盐酸反应,生成氯化钠,氢氧化钙与盐酸反应,生成氯化钙,盐酸与碳酸钠反应,生成氯化钠、水和二氧化碳;
①烧杯中能跟稀盐酸发生化学反应的物质有4种(酚酞除外);
②最终得到的溶液中:一定含有的溶质是NaCl、CaCl2;一定不含有的溶质是Ca(OH)2、NaOH、Na2CO3;如果盐酸有剩余,则可能含有的溶质是HCl;
【实验验证】碳酸钠与盐酸反应,产生二氧化碳气体,为了验证最终得到的溶液中可能含有的溶质是否存在,小组的同学取少量烧杯中的溶液于试管中,向其中逐滴加入碳酸钠溶液直至过量,观察到有气泡产生,证明含有该溶质;
【拓展延伸】氢氧化钙和二氧化硫反应生成碳酸钙和水,反应的化学方程式为:SO2+Ca(OH)2═ CaSO3↓+H2O。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】下列实验方案及现象与结论一致的是
项目 | A | B | C | D |
方案 |
|
|
|
|
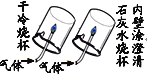
现象 | 蜡烛由低到高依次熄灭 | 干冷烧杯内壁出现无色液滴,澄清石灰水变浑浊 | 振荡后,塑料瓶变瘪 | 水中的铁钉生锈,植物油中的铁钉没生锈 |
结论 | 一般情况下,二氧化碳不燃烧也不支持燃烧,密度比空气大 | 气体中一定有碳、氢元素、氧元素 | 二氧化碳能溶于水也能和水发生反应 | 铁生锈只需要与氧气接触 |
A. A B. B C. C D. D