题目内容
【题目】现欲探究一固体混合物 A的成分,已知其中可能含有NH4NO3、NaCl、BaCO3、Cu(NO3)2四种物质中的两种或多种。按下述步骤进行实验探究,观察实验现象,并加以分析推理(设过程中所有发生的反应都恰好完全反应)
I.取一定质量的该固体混合物A放入一洁净烧杯中,向其中加入足量水,搅拌,待烧杯中物质充分混合后,过滤,得白色沉淀B和蓝色滤液C.
II向步骤I所得滤液C中滴加适量氢氧化钠溶液,出现的现象如图中所述:

试根据实验过程和发生的现象判断:
(1)白色沉淀B是____________(写化学式)。
(2)固体混合物A中一定存在的物质是____________(写化学式)。
(3)写出实验过程①中生成蓝色沉淀F的化学方程式______________________。
(4)滤液D中一定大量存在的酸根离子为__________(写离子符号)。
(5)若要检验混合物A中不能确定的物质是否存在,可以用无色滤液D进一步实验,请简述实验操作步骤,发生的现象及结论:________________。
【答案】BaCO3 BaCO3、Cu(NO3)2、NH4NO3 Cu(NO3)2+2NaOH = Cu(OH)2↓+2NaNO3 NO3- 取溶液D少许,向其中加入硝酸银和稀硝酸溶液,若出现白色沉淀,证明有氯化钠,否则没有。(只加入硝酸银溶液也可以得满分)
【解析】
固体混合物A加水溶解、过滤后得白色沉淀B和蓝色滤液C,则B为BaCO3,滤液C中一定有Cu(NO3)2;蓝色滤液C加氢氧化钠后得到蓝色沉淀F和气体E,则F为Cu(OH)2,E为NH3,则说明原白色固体A中一定有NH4NO3,题干中的现象不能确定原白色固体中是否有NaCl.
由分析知白色沉淀B是BaCO3;
由分析知,固体混合物A中一定存在BaCO3、Cu(NO3)2、NH4NO3;
蓝色沉淀F是Cu(NO3)2和NaOH反应生成得,化学方程式为:Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3;
混合物A中不能确定的物质是NaCl,NaCl和AgNO3反应会产生白色沉淀,故通过AgNO3来检验:取溶液D少许,向其中加入硝酸银和稀硝酸溶液,若出现白色沉淀,证明有氯化钠,否则没有。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】在学完酸碱盐的知识后,某兴趣小组开展了如下的探究,请回答相关问题。
(1)向石灰乳中加入一定量的稀盐酸,得到了澄清溶液,写出发生反应的化学方程式:__________________________。已知氯化钙溶液显中性,现用pH计测得反应后的溶液的pH=4.3,则此时溶液里的粒子示意图正确的是_______(填字母序号)。
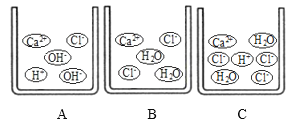
(2)已知常温下氢氧化钙的溶解度为 0.17g。若将石灰乳静置一段时间,则得到的上层澄清液体的溶质质量分数为_____(精确到 0.01%)。
(3)向石灰石中加入稀硫酸,发现反应缓慢,如何提高该反应速率呢?
查阅资料:石灰石与稀硫酸反应生成 CaSO4,同时产生CO2气体;且CaSO4 微溶于水。
Ⅰ.甲同学认为可以用增大稀硫酸浓度的方法来提高该反应速率。取相同质量相同规格的石灰石进行了如下实验:
实验 | ①10%硫酸溶液 | ②20%硫酸溶液 | ③40%硫酸溶液 |
观察1分钟内石灰石表面的气泡放出快慢 | 缓慢 | 明显加快 | 开始很快、又迅速变慢 |
由上述实验现象可知,增大稀硫酸的浓度_____(填“一定”或“不一定”)能提高该反应速率。请推测出现实验③中现象的原因:______________________________
Ⅱ.写出另外一种提高该反应速率方法:_____________________________。
【题目】如图表示某个化学反应,据图分析判断,下列各项中,不正确的是( )
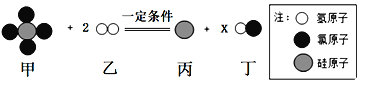
A. 该反应属于置换反应.
B. 反应中乙、丙两物质质量比为2: 7
C. 图示中x的数值为4
D. 反应前后氢元素的化合价发生了改变
【题目】为了测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关得实验数据记录如下(实验中的误差忽略不计)
第一次 | 第二次 | 第三次 | |
所取合金的质量/g | 25 | 25 | 50 |
所用稀硫酸的质量/g | 120 | 160 | 100 |
生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
(1)从上表数据分析,当所取合金与所用稀硫酸的质量比为_____时,表明合金中的锌与稀硫酸中的硫酸完全反应.
(2)试计算该铜锌合金中锌的质量分数_____.
(3)所用稀硫酸溶液的溶质的质量分数_____.