题目内容
某同学用如图所示装置制取纯净、干燥的CO,并测定某氧化铜和铜的混合物中铜单质的含量.
资料:
①常温下,甲酸(HCOOH)是无色易挥发的液体,在浓硫酸作用下易分解.
甲酸分解的化学方程式为:HCOOH
 CO↑+H2O.
CO↑+H2O.②浓硫酸具有吸水性,难挥发,常用作干燥剂.
(1)E中澄清石灰水变浑浊,反应的化学方程式是______.
(2)装置B的作用是______,装置C中的试剂是______.点燃装置F中酒精灯的目的是______.
(3)实验结束时,熄灭酒精灯的顺序是______(填对应装置序号).
(4)若称取该混合物5.0g,充分反应后,玻璃管中剩余固体的质量为4.8g.原混合物中铜单质的质量分数为______.
【答案】分析:根据已有的知识进行分析,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀,使溶液变浑浊,一氧化碳是有毒的气体,排放到空气中会污染空气,可以利用一氧化碳的可燃性进行燃烧处理,一氧化碳还原氧化铜生成铜和二氧化碳,会导致固体的质量减小,减小的质量即是氧化铜中氧元素的质量,据此可以进行解答.
解答:解:(1)二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,故填:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)制取纯净、干燥的CO,需要将挥发出的甲酸和一氧化碳中混有的水蒸气除掉,要除去水蒸气可以利用浓硫酸的吸水性,一氧化碳是有毒的气体,排放到空气中会污染空气,可以利用一氧化碳的可燃性进行燃烧处理,故填:除去挥发出来的甲酸,浓硫酸,处理尾气,防止空气污染;
(3)实验结束时,要先停止给盛有固体样品的玻璃管加热,继续通入一氧化碳知道玻璃管冷却,故需要先停止D,然后停止A,由于一氧化碳是有毒的气体,故F最后停止,故填:DAF;
(4)由题意可以知道,固体质量减少0.2g,设氧化铜的质量为x
CuO+CO Cu+CO2 △m
Cu+CO2 △m
80 64 16
x 0.2g

x=1g
故原混合物中铜的质量为:5g-1g=4g
铜单质的质量分数为: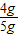 ×100%=80%
×100%=80%
故填:80%.
点评:本题考查了一氧化碳的性质,完成此题,可以依据已有的知识进行.要求同学们熟练掌握一氧化碳的性质,以便灵活应用.
解答:解:(1)二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,故填:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)制取纯净、干燥的CO,需要将挥发出的甲酸和一氧化碳中混有的水蒸气除掉,要除去水蒸气可以利用浓硫酸的吸水性,一氧化碳是有毒的气体,排放到空气中会污染空气,可以利用一氧化碳的可燃性进行燃烧处理,故填:除去挥发出来的甲酸,浓硫酸,处理尾气,防止空气污染;
(3)实验结束时,要先停止给盛有固体样品的玻璃管加热,继续通入一氧化碳知道玻璃管冷却,故需要先停止D,然后停止A,由于一氧化碳是有毒的气体,故F最后停止,故填:DAF;
(4)由题意可以知道,固体质量减少0.2g,设氧化铜的质量为x
CuO+CO
 Cu+CO2 △m
Cu+CO2 △m80 64 16
x 0.2g

x=1g
故原混合物中铜的质量为:5g-1g=4g
铜单质的质量分数为:
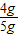 ×100%=80%
×100%=80%故填:80%.
点评:本题考查了一氧化碳的性质,完成此题,可以依据已有的知识进行.要求同学们熟练掌握一氧化碳的性质,以便灵活应用.

练习册系列答案
相关题目
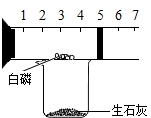 某同学用如图所示装置粗略测定空气中氧气的体积分数.图中烧杯上方玻璃管(预先固定好)中部有一左右滑动的活塞,活塞的左端内有空气,右端管口跟空气相通,实验开始前活塞处在5厘米处.实验开始时,向烧杯中加入适量水(水与生石灰反应能产生大量热使白磷燃烧).则:
某同学用如图所示装置粗略测定空气中氧气的体积分数.图中烧杯上方玻璃管(预先固定好)中部有一左右滑动的活塞,活塞的左端内有空气,右端管口跟空气相通,实验开始前活塞处在5厘米处.实验开始时,向烧杯中加入适量水(水与生石灰反应能产生大量热使白磷燃烧).则: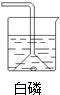
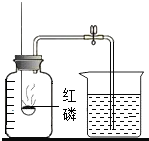 某同学用如图所示装置测定空气中氧气的体积分数,实验后发现所测定氧气的体积分数大于
某同学用如图所示装置测定空气中氧气的体积分数,实验后发现所测定氧气的体积分数大于
 某同学用如图所示装置测定空气中氧气的体积分数.
某同学用如图所示装置测定空气中氧气的体积分数.