题目内容
实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+ 2H2SO4(浓)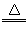 ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4( 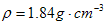 )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质,进行了如下实验探究。查资料:
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质,进行了如下实验探究。查资料:
(1)SO2气体通入品红溶液会使溶液褪色。
(2)随着反应的进行,浓硫酸会变稀。
(3)SO2气体的性质与CO2相似。F中盛放的是无水硫酸铜。
(1)化学小组所制得的气体中混有的主要杂质气体可能是___________(填化学式)。产生这种结果的主要原因是__________(用化学方程式或必要的文字加以说明)
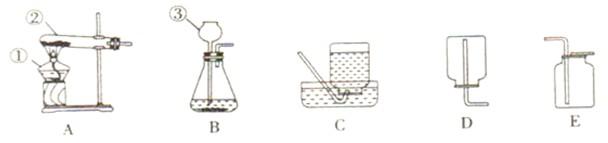
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
 ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4( 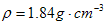 )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质,进行了如下实验探究。查资料:
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质,进行了如下实验探究。查资料:(1)SO2气体通入品红溶液会使溶液褪色。
(2)随着反应的进行,浓硫酸会变稀。
(3)SO2气体的性质与CO2相似。F中盛放的是无水硫酸铜。
(1)化学小组所制得的气体中混有的主要杂质气体可能是___________(填化学式)。产生这种结果的主要原因是__________(用化学方程式或必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
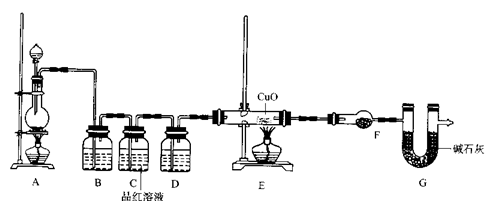
①装置B中加入的试剂 ,作用是 。
②装置D加入的试剂 ,装置F中试剂的作用 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 .
②装置D加入的试剂 ,装置F中试剂的作用 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 .
(1)H2;随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2 Zn+H2SO4===ZnSO4+H2↑
(2)①NaOH溶液,(其它合理答案也给分) ;除去混合气体中的SO2。
②浓硫酸;检验生成物中有水
③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色
④防止空气中H2O进入干燥管而影响杂质气体的检验
(2)①NaOH溶液,(其它合理答案也给分) ;除去混合气体中的SO2。
②浓硫酸;检验生成物中有水
③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色
④防止空气中H2O进入干燥管而影响杂质气体的检验

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

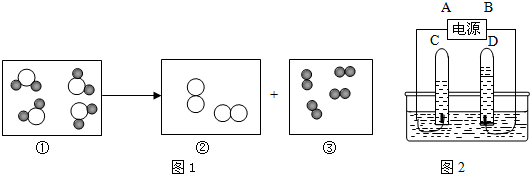
 ”表示氢原子,“
”表示氢原子,“ ”表示氧原子.表示化合物的是(填序号)
”表示氧原子.表示化合物的是(填序号)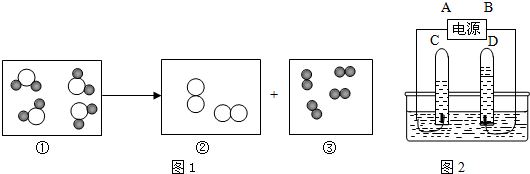
 ”表示氢原子,“
”表示氢原子,“ ”表示氧原子.表示化合物的是(填序号)______,③所代表的物质是图中 试管______(填字母) 中产生的气体,图2中A是电源的______(填“正”或“负”) 极.
”表示氧原子.表示化合物的是(填序号)______,③所代表的物质是图中 试管______(填字母) 中产生的气体,图2中A是电源的______(填“正”或“负”) 极.