题目内容
【题目】在 200g4.0%的氢氧化钠溶液中加入 150 g 盐酸时溶液 pH=7.求:
(1)所得混合溶液中氯化钠的质量分数________;
(2)若所用盐酸由 36.5%(密度为 1.2 g/cm3)的浓盐酸来配制,需要浓盐酸的体积是多少________?
【答案】3.3% 16.7mL
【解析】
200g 4.0%的氢氧化钠溶液中氢氧化钠的质量=200g×4.0%=8g。
(1)设生成氯化钠的质量为x,150g盐酸中溶质的质量为y。
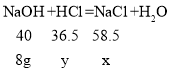
![]() x=11.7g;
x=11.7g;
![]() y=7.3g;
y=7.3g;
所得混合溶液中氯化钠的质量分数为![]()
(2)由上分析可知所用盐酸中溶质质量为7.3g,需要浓盐酸的质量为7.3g÷36.5%=20g,需要浓盐酸的体积为20g÷1.2g/cm3≈16.7cm3=16.7mL.
答:(1)所得混合溶液中氯化钠的质量分数为3.3%;
(2)需要浓盐酸的体积为16.7mL。

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
【题目】X 是合成维生素A的重要原料.工业上用物质甲和乙在一定条件下反应生成物质丙和X,甲、乙和丙的微观示意图见下表.
物质 | 甲 | 乙 | 丙 | X | |
微观示意图 |
|
|
| ? |
|
该反应中甲、乙、丙的质量比为 23:17:1.下列判断不正确的是( )
A.X 属于化合物B.该反应方程式中乙与丙的化学计量数之比为 2:3
C.物质X 中含三种元素D.该反应为置换反应