题目内容
现有含少量硝酸钡杂质的固体氯化钡样品,取12.5g样品放入烧杯中,然后加入37.5g水使其完全溶解.取10g溶液,加入100g硝酸银溶液,恰好完全反应生成白色沉淀,过滤后得到107.13g的滤液,试计算:
(1)样品中氯化钡的质量;
(2)107.13g滤液的溶质质量分数.
解:氯化银沉淀质量=10g+100g-107.13 g=2.87 g
设生成的硝酸钠质量为x,反应的氯化钡质量为y.
BaCl2+2AgNO3═2AgCl↓+Ba(NO3)2
208 287 261
y 2.87 g x
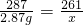
x=2.61 g
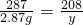
y=2.08 g
设原样品中氯化钡的质量为m.
2.08 g:10 g=m:(12.5 g+37.5 g)
m=10.4 g
则原样品中硝酸钡的质量=12.5 g-10.4 g=2.1 g
所以,取出的10g溶液中硝酸钡的质量=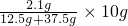 =0.42 g
=0.42 g
则所得滤液的溶质质量分数为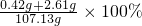 =2.8%
=2.8%
答:(1)样品中氯化钡的质量为10.4 g;
(2)107.13g滤液的溶质质量分数为2.8%.
分析:(1)根据样品中氯化钡的质量:利用溶液的均一性,由10g滤液中氯化钡与水的质量关系,计算出39.6g水中所溶解氯化钡的质量进行解答;
(2)根据反应后得到硝酸钡溶液,利用滤液中溶质的质量分数= ×100%,注意硝酸钡的质量不只是生成的硝酸钡还有原来的硝酸钡.
×100%,注意硝酸钡的质量不只是生成的硝酸钡还有原来的硝酸钡.
点评:利用溶液的均一性,根据部分溶液中溶质与溶剂的质量比,利用溶液中水的质量计算出所溶解溶质的质量是解决本题的技巧.
设生成的硝酸钠质量为x,反应的氯化钡质量为y.
BaCl2+2AgNO3═2AgCl↓+Ba(NO3)2
208 287 261
y 2.87 g x
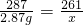
x=2.61 g
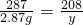
y=2.08 g
设原样品中氯化钡的质量为m.
2.08 g:10 g=m:(12.5 g+37.5 g)
m=10.4 g
则原样品中硝酸钡的质量=12.5 g-10.4 g=2.1 g
所以,取出的10g溶液中硝酸钡的质量=
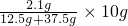 =0.42 g
=0.42 g 则所得滤液的溶质质量分数为
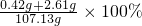 =2.8%
=2.8%答:(1)样品中氯化钡的质量为10.4 g;
(2)107.13g滤液的溶质质量分数为2.8%.
分析:(1)根据样品中氯化钡的质量:利用溶液的均一性,由10g滤液中氯化钡与水的质量关系,计算出39.6g水中所溶解氯化钡的质量进行解答;
(2)根据反应后得到硝酸钡溶液,利用滤液中溶质的质量分数=
 ×100%,注意硝酸钡的质量不只是生成的硝酸钡还有原来的硝酸钡.
×100%,注意硝酸钡的质量不只是生成的硝酸钡还有原来的硝酸钡.点评:利用溶液的均一性,根据部分溶液中溶质与溶剂的质量比,利用溶液中水的质量计算出所溶解溶质的质量是解决本题的技巧.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目