题目内容
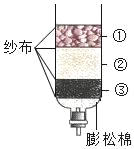
【题目】下图是实验室模拟工业上用大理石(含少量 Fe2O3 和 SiO2 )为原料提纯碳酸钙的实验流程。请回答下列问题:
已知: ①SiO2 不溶于水也不溶于酸
②氨水呈碱性,与盐酸反应的化学方程式为:NH3H2O+HCl=NH4Cl+H2O
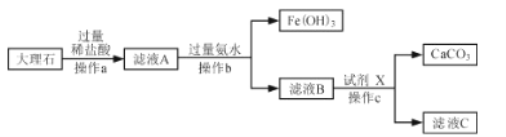
(1)稀盐酸不能用稀硫酸代替,原因是 ______。
(2)操作a中需要用到的玻璃仪器有烧杯、玻璃棒和______。
(3)写出滤液 A 中加氨水生成Fe(OH)3的化学方程式 ______。
(4)滤液B 中加入试剂 X 恰好完全反应,X的化学式为______。
【答案】硫酸和块状大理石反应生成微溶的硫酸钙附着在碳酸钙的表面,阻止反应的继续进行 漏斗 3NH3H2O+FeCl3=Fe(OH)3↓+3NH4Cl NH4HCO3
【解析】
(1)稀盐酸不能用稀硫酸代替,原因是硫酸和块状大理石反应生成微溶的硫酸钙附着在碳酸钙的表面,阻止反应的继续进行;
(2)操作a是固体和液体分离的操作,为过滤,所以需要用到的玻璃仪器有烧杯、玻璃棒和漏斗;
(3)根据“氨水呈碱性,与盐酸反应的化学方程式为:NH3H2O+HCl=NH4Cl+H2O”,可知氨水显碱性,生成物中存在铵根离子,所以滤液A中加氨水生成Fe(OH)3和氯化铵,对应的化学方程式为 3NH3H2O+FeCl3=Fe(OH)3↓+3NH4Cl;
(4)滤液B中含有生成的氯化钙和剩余的NH3H2O,加入试剂X恰好完全反应,氨水中存在氢氧根离子,能与碳酸氢铵反应生成碳酸铵和水,碳酸铵与氯化钙反应生成碳酸钙和氯化铵,所以加入的X的化学式为NH4HCO3。

【题目】工业中利用如下反应合成SO3:2SO2+O2![]() 2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A. 丁物质一定是催化剂V2O5
B. 参加反应的SO2分子、O2分子的个数比为2:1
C. 丙物质是O2
D. d=15