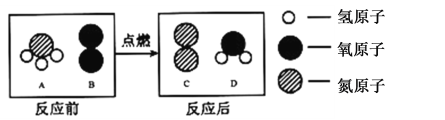
题目内容
【题目】下图是五种粒子的结构示意图,请回答下列问题:
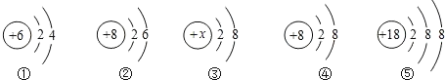
(1)③带有2个单位正电荷,则x=_____,该粒子的符号为_____。
(2)属于稳定结构的原子是_____;属于同种元素的粒子是_____;属于阴离子的是_____(都填序号)。
【答案】12 Mg2+ ⑤ ②④ ④
【解析】
原子或离子结构示意图中,圆圈内的数字表示核内质子数,弧线上的数字表示各层电子数;原子中质子数与电子数相等,阴离子的质子数小于电子数,据此分析。
(1)由图③可知,该粒子的核外电子数为10,带两个单位正电荷,则x=2+8+2=12,所以该粒子为Mg2+;
(2)③④⑤的最外层电子数为8,属于稳定结构,其中⑤的电子数与质子数相等,属于原子,因此属于稳定结构的原子是⑤;②④的质子数均为8,则②④属于同种元素的粒子;④的质子数小于核外电子数之和,因此④属于阴离子。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】某班同学按下图所示的实验探究质量守恒定律。
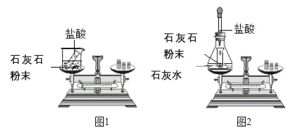
(1)同学们先按图1的方式实验,该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是_____(填字母)。
A | B | C | D | |
盐酸加入CaCO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
盐酸加入CaCO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴入盐酸,最终天平的状态是_____(填字母)。
A 左盘高
B 右盘高
C 保持平衡
(3)该实验中通过化学反应新生成的物质有_____、_____(填字母)。
A HCl
B CO2
C CaCO3
D NaOH
【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于如表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 20 | 17.4 |
第2次 | 20 | 14.8 |
第3次 | 20 | 12.2 |
第4次 | 20 | 12 |
第5次 | 20 | m |
试回答下列问题:
(1)上述表格中m的值为_____;
(2)黄铜样品中锌的质量为_____;
(3)所用稀硫酸中硫酸的质量分数是_____。
【题目】在一个堆放了一批袋装碳酸氢(NH4HCO3)化肥的小仓库里,过了一个夏天,管理员发现仓库里这种化学所特有的刺激性气味变得浓烈了。有些袋里的化肥变少了。检查发现变少了。检查发现:变少的化肥包裝袋上有少许破损.但没有发现化肥酒落在地上。化学活动小组为了探究化肥变少的原因提出了自己的猜想并设计了如图的实验。他们的实验记录如下表:
实验步骤 | 实验现象 |
取少量碳酸氢铵固体粉末放入蒸发皿中,并将蒸发皿放在酒精灯上加热 | ①白色固体逐渐消失;②____ |

(1)碳酸氢铵受热后分解,出现实验现象①的原因是___,若他们的猜想正确,实验现象②应为___
(2)写出该反应的化学方程式___
(3)碳酸氢铵应如何保存?____
(4)某固体物质受热后变化为态这种变化属于(_________)
A 一定是物理变化
B 一定是化学变化
C 可能是物理变化,也可能是化学变化
D 既不是物理变化也不是化学变化
(5)已知常见的相对原子质量有: H-I,C-12,N-I4,O-16通过计算写出结果
①碳酸氢铵的相对分子质量为:____
②各元素质量比为:_____
③氮元素的质量分数为(保留到0.001 ):____