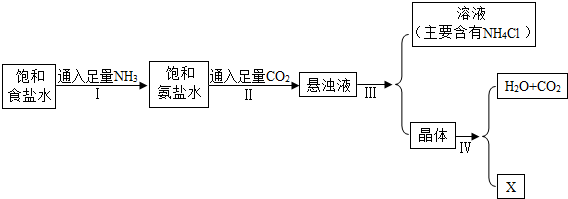
题目内容
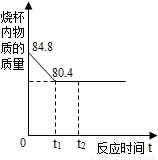 工业上用侯氏制碱法制得的纯碱样品中含有一定量的氯化钠.现称取只含有氯化钠杂质的纯碱样品11.8g放入盛73g稀盐酸的烧杯中,恰好完全反应.反应过程中烧杯内物质的质量随时间的变化关系如图所示.试回答下列问题:
工业上用侯氏制碱法制得的纯碱样品中含有一定量的氯化钠.现称取只含有氯化钠杂质的纯碱样品11.8g放入盛73g稀盐酸的烧杯中,恰好完全反应.反应过程中烧杯内物质的质量随时间的变化关系如图所示.试回答下列问题:(1)反应过程中放出CO2的质量______g.
(2)求样品中碳酸钠的质量.
(3)所用稀盐酸的质量分数.
【答案】分析:(1)由于碳酸钠和稀盐酸反应能产生二氧化碳,并从烧杯中逸出,因此烧杯中物质变化的质量就是生成二氧化碳的质量.
(2)由生成二氧化碳的质量根据碳酸钠与稀盐酸反应的化学方程式可以计算出样品中碳酸钠的质量和消耗的盐酸的质量.进而计算出第(3)问中盐酸的质量分数.
解答:解:(1)生成二氧化碳的质量即为反应前后烧杯中物质质量的减少量,即84.8g-80.4g=4.4g
故答案为:4.4
(2)设样品中碳酸钠的质量为x,消耗HCl的质量为y.
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
106 2×36.5 44
x y 4.4g

解之得:x=10.6g,y=7.3g
答:样品中碳酸钠的质量为10.6g.
(3)所用盐酸的质量分数= ×100%=
×100%= ×100%=10%
×100%=10%
答:所用盐酸的质量分数为10%
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
(2)由生成二氧化碳的质量根据碳酸钠与稀盐酸反应的化学方程式可以计算出样品中碳酸钠的质量和消耗的盐酸的质量.进而计算出第(3)问中盐酸的质量分数.
解答:解:(1)生成二氧化碳的质量即为反应前后烧杯中物质质量的减少量,即84.8g-80.4g=4.4g
故答案为:4.4
(2)设样品中碳酸钠的质量为x,消耗HCl的质量为y.
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
106 2×36.5 44
x y 4.4g

解之得:x=10.6g,y=7.3g
答:样品中碳酸钠的质量为10.6g.
(3)所用盐酸的质量分数=
 ×100%=
×100%= ×100%=10%
×100%=10%答:所用盐酸的质量分数为10%
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目