题目内容
【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应,试与他们一起完成实验方案的设计,实施和评价,并得出有关结论.
(1)探究稀硫酸与氢氧化钠溶液的反应:
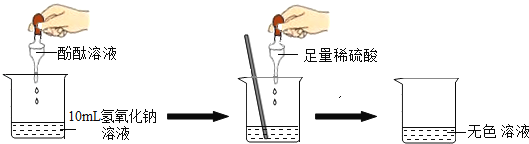
根据上述实验中颜色变化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式为:___________________________.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
上述设计的实验方案中,正确的是_____(填“方案一”或“方案二”)
另外一个实验方案错误的原因是________________________________________________;
请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是__,实验现象及结论是_____________________________________________________.
【答案】 2NaOH+H2SO4=Na2SO4+2H2O 方案二 NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4 锌粒 若有气体放出,证明稀硫酸过量,反之稀硫酸不过量
【解析】(1)稀硫酸与氢氧化钠溶液反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O (2)方案二是正确的,方案一中, NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4 ,无法证明硫酸是否过量。稀硫酸能与锌反应生成氢气,若有气体放出,证明稀硫酸过量,反之稀硫酸不过量。

 阅读快车系列答案
阅读快车系列答案【题目】物质的性质决定其用途,下列物质的用途与性质对应不正确的是
选项 | 物 质 | 用 途 | 性 质 |
A | 二氧化碳 | 作气体肥料 | 二氧化碳既不燃烧也不支持燃烧 |
B | 熟石灰 | 改良酸性土壤 | 熟石灰能与酸发生中和反应 |
C | 小苏打 | 治疗胃酸过多 | 小苏打能与盐酸反应 |
D | 氮气 | 焊接金属时做保护气 | 氮气的化学性质不活泼 |
A. A B. B C. C D. D
【题目】金属用途广泛,其结构和性质等是化学的重要研究内容。
(1)下图是铝的原子结构示意图。下列说法不正确的是 。
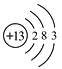
A.铝原子的质子数为13 |
B.在化合物中铝通常显+3价 |
C.铝是地壳中含量最多的元素 |
D.铝可作导线是由于它具有良好的导电性 |
(2)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了下图实验,并对溶液A和固体B的成分进行了分析和实验探究。

【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】①只有Zn(NO3)2② Zn (NO3)2、AgNO3③ Zn (NO3)2、Cu(NO3)2④Zn (NO3)2、AgNO3、Cu(NO3)2
【交流讨论】不合理的猜想是 (填标号),其理由是 。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
实验步骤 | 现 象 | 有关反应的化学方程式 |
取少量固体B, | 有气泡产生 |
|
【题目】下列对宏观事实的微观解释不合理的是( )
选项 | 宏观事实 | 微观解释 |
A | 冰水混合物是纯净物 | 只有一种分子构成 |
B | 夏天钢轨之间的缝隙变小 | 温度升高,原子间的间隔变大 |
C | 金刚石、石墨的物理性质差异较大 | 构成它们的微粒种类不同 |
D | 氢氧化钾。氢氧化钠都具有碱性 | 在水中均能解离出 |
A. A B. B C. C D. D
