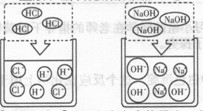
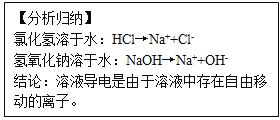
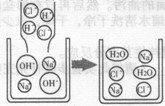
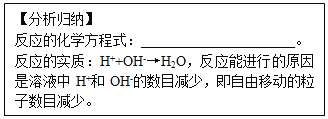
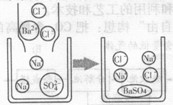
题目内容
【题目】纯净的过氧化钙(CaO2)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。其制备方法如下:以氢氧化钙和氯化铵为原料,制取CaO2·8H2O(搅拌时发生的化学反应方程式为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl),再经脱水制得CaO2。
其流程如下:
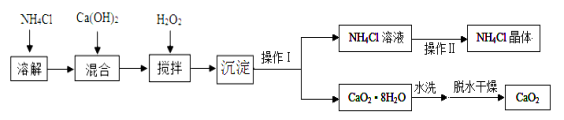
(1)操作Ⅰ的名称是 ,该操作中需要用到玻璃棒,其作用是 。
(2)“沉淀”时需控制温度在0~2℃,比较简单易行的方法是将反应容器放置在 中,制备CaO2·8H2O时反应温度不宜过高,原因一是防止因温度过高导致氨水挥发,原因二是防止 。(用化学方程式表示)
(3)为检验“水洗”是否合格,可取最后一次洗涤液少量于试管中,再滴加 (填试剂),若无白色沉淀产生说明“水洗”合格。
(4)该流程中除水外可循环利用的物质是 (填化学式)。
【答案】(1)过滤,引流(2)冰水,2H2O2==2H2O+O2↑(3)AgNO3(4)NH4Cl
【解析】
试题分析:(1)操作Ⅰ的名称是过滤,因为过程中得到了固体和液体的分离,该操作中需要用到玻璃棒,其作用是引流。“沉淀”时需控制温度在0~2℃,比较简单易行的方法是将反应容器放置在冰水中,制备CaO2·8H2O时反应温度不宜过高,原因一是防止因温度过高导致氨水挥发,原因二是防止2H2O2===2H2O+O2↑。为检验“水洗”是否合格,可取最后一次洗涤液少量于试管中,再滴加硝酸银溶液,若无白色沉淀产生说明“水洗”合格。从图示看:该流程中除水外可循环利用的物质是NH4Cl。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目