题目内容
【题目】反思、归纳与提升是化学学习的重要方法。对于复分解反应及其规律,通过反思与探索,同学们有了新的认识。请填写下文中横线上的空白。
【知识回顾】
1.氯化氢气体、氢氧化钠固体不导电。
2.盐酸、氢氧化钠溶液能导电
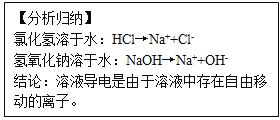
【迁移运用】硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4→________。
【探索发现】
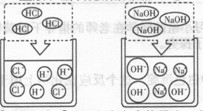
(1)氢氧化钠溶液与盐酸反应的微观示意图
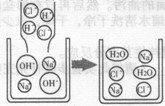
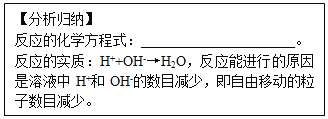
(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图
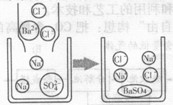

(提示:生成硫酸钡白色沉淀)
(3)有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++CO32-→________________。
【总结规律】
上述复分解反应能发生的本质原因____________________________________。
【答案】【迁移运用】2Na++SO42-
【探索发现】(1)NaOH+HCl=NaCl+H20(2)BaCl2+Na2SO4=BaS04↓+2NaCl,Ba2+和SO42- (3)H20+CO2↑
【总结规律】溶液中自由移动的离子的数目减少
【解析】
试题分析:硫酸钠溶液能导电,原因是硫酸钠溶于水是因为硫酸钠能够在水中解离出钠离子和硫酸根离子, 氢氧化钠溶液与盐酸反应为 NaOH+HCl=NaCl+H20,硫酸钠溶液跟氯化钡溶液反应BaCl2+Na2SO4=BaS04↓+2NaCl;反应能进行的原因是溶液中的Ba2+和SO42- 数目减少,因为二者会反应产生沉淀,即自由移动的离子数目减少。有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++CO32-→H20+CO2↑,上述复分解反应能发生的本质原因溶液中自由移动的离子的数目减少。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目