题目内容
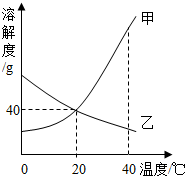 甲和乙两种物质的溶解度曲线如图.
甲和乙两种物质的溶解度曲线如图.(1)20℃时,甲物质的溶解度为
(2)20℃时,将甲、乙两物质的饱和溶液各100g,分别升温到40℃,(不考虑水分的蒸发)所得甲物质溶液的质量
(3)A、B两烧杯中分别装有40℃的100g和200g的相同浓度的甲的不饱和溶液,将两份溶液分别都恒温蒸发20g水,都析出了晶体.析出晶体的质量关系为A
考点:固体溶解度曲线及其作用,晶体和结晶的概念与现象,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:根据溶解度曲线的意义进行分析解答,据图可以知道在某温度下物质的溶解度;根据物质的溶解度随温度的变化特点确定升高温度后的变化;根据溶解度的大小确定析出晶体的质量关系.
解答:解:(1)20℃时,甲物质的溶解度为40g,故填:40g;
(2)20℃时,将甲、乙两物质的饱和溶液各100g,分别升温到40℃,甲的溶解度随温度的升高而增大,溶液质量不变,乙的溶解度随温度的升高而减小,会析出固体而导致溶液质量减小,故甲溶液质量大于乙溶液质量;过滤后再将两溶液恢复至20℃,由于乙溶液析出固体,溶质质量分数变小,故甲物质溶液中溶质的质量分数大于乙物质溶液中溶质的质量分数,故填:>,>;
(3)A、B两烧杯中分别装有40℃的100g和200g的相同浓度的甲的不饱和溶液,将两份溶液分别都恒温蒸发20g水,都析出了晶体,由于A烧杯中先达到饱和溶液,故析出晶体的质量大于乙烧杯,故填:>.
(2)20℃时,将甲、乙两物质的饱和溶液各100g,分别升温到40℃,甲的溶解度随温度的升高而增大,溶液质量不变,乙的溶解度随温度的升高而减小,会析出固体而导致溶液质量减小,故甲溶液质量大于乙溶液质量;过滤后再将两溶液恢复至20℃,由于乙溶液析出固体,溶质质量分数变小,故甲物质溶液中溶质的质量分数大于乙物质溶液中溶质的质量分数,故填:>,>;
(3)A、B两烧杯中分别装有40℃的100g和200g的相同浓度的甲的不饱和溶液,将两份溶液分别都恒温蒸发20g水,都析出了晶体,由于A烧杯中先达到饱和溶液,故析出晶体的质量大于乙烧杯,故填:>.
点评:本题考查了溶解度曲线的应用,完成此题,可以依据溶解度曲线的意义进行.

练习册系列答案
相关题目
小华在实验室选用Fe,CaCO3,H2O,CuSO4,Na2CO3和稀HCl欲制备下列四种物质,其中不能达到目的是( )
| A、CO2 |
| B、Cu |
| C、H2SO4 |
| D、NaOH |
 KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题:
KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题: