题目内容
将5.0g炭粉和氧化铜的混合物装入试管中,充分加热使氧化铜全部参加反应,然后冷却、称量,发现剩余固体质量为3.9g。(已知:炭粉足量,且炭粉中杂质没有发生化学反应;原试管中无氧气;化学方程式为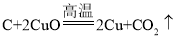 )。求:
)。求:
(1)反应中产生二氧化碳的质量为 g。
(2)原混合物中氧化铜的质量分数。
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案除去下列各组物质中少量的杂质,所用试剂或方法不正确的是( )
物质 | 杂质 | 除杂所用试剂或方法 | |
A | CO2 | CO | 点燃 |
B | NaOH | Ca(OH)2 | 适量的Na2CO3 |
C | Cu | Fe | 加入足量盐酸,过滤 |
D | CaO | CaCO3 | 高温煅烧 |
A.A B.B C.C D.D
我国是世界化肥第一生产大国和消费大国。以空气和煤炭等为化工原料,可合成氨、尿素(CO(NH2)2),主要生产工艺流程如下图所示。回答下列问题:

(1)工业合成氨的原料是氮气和氢气,氮气可从空气分离中获得。从液态空气中分离出N2的过程属于____(填“物理”或“化学”)变化。空气中含量少量的稀有气体,其化学性质极为_____(填“活泼”或“稳定”)。
(2)氢气通过煤和水蒸气在高温时反应得到的合成气(H2、CO)提取,制备合成气前需先将煤粉碎,这样做的目的是_____,反应的基本类型为________。
(3)写出合成塔①中合成氨的化学方程式为________。尿素属于_____(填“氮”“钾”“磷”或“复合”)肥。
(4)压强为101kPa下,氨气在不同温度下的溶解度如下表。氨水是氨气的水溶液,贮存时氨水要注意_____。
温度/℃ | 10 | 20 | 30 | 60 |
溶解度/g | 70 | 56 | 44.5 | 20 |
(5)2019年全国节能宣传周主题为“绿色发展,节能先行”。其中符合要求的___(填序号)
A 烟囱中排放出未经处理的烟尘、废水和废气
B 综合采用煤的洁净化技术
C 循环利用氮气、氢气和水
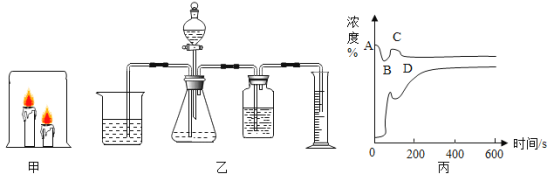
某校化学兴趣小组同学将一只烧杯罩在2支高低不同的燃着的蜡烛上(如图1所示),发现总是高的蜡烛先熄灭。请你同他们一起进行探究。
(提出问题)为什么高的蜡烛先熄灭?
(猜想假设)猜想1:高的蜡烛先灭是因为上部的二氧化碳浓度高;猜想2:高的蜡烛先灭是因为上部的氧气先被消耗。
(实验探究1)为了验证猜想1是否成立,冰冰同学进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
将浸有澄清石灰水的滤纸条分别放在烧杯的顶部和底部,在滤纸条上滴加酚酞,变色后,用烧杯罩住点燃的高低蜡烛,观察高低滤纸条褪色顺序(实验装置如图甲所示) | _________ | 猜想1成立,该实验涉及的反应的化学方程式为_________ |
明明对冰冰的结论表示怀疑,他用图乙装置收集一瓶80%二氧化碳和20%氧气的混合气体,然后将燃着的蜡烛伸入收集的混合气体瓶中,发现_________,从而证明冰冰的结论不正确。
(实验探究2)明明为了验证猜想2,他利用手持技术实验,用O2、CO2传感器在烧杯顶部测量杯内两支蜡烛从点燃到全部熄灭后,杯内O2和CO2的浓度变化,如图丙所示,图中______(填“上方”或“下方”)的曲线表示CO2浓度的变化。反应后剩余氧气浓度为15.65%,二氧化碳浓度为1.898%,氧气浓度明显下降,二氧化碳浓度却增大不多。
(实验结论)___________。
(反思评价)根据图2中上面一条曲线(装置内氧气浓度)变化分析,在________(填“A”“B”“C”或“D”)点时蜡烛全部熄灭:请解释曲线AB段、BC段、CD段变化的原因。
AB段:_____________;BC段:___________;CD段:_________


