题目内容
【题目】碘是甲状腺激素的主要成分。碘元素的部分信息如图。 则下列说法错误的是
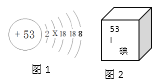
A. 图1表示的微粒是I—
B. 人体中碘是常量元
C. X = 8
D. 碘原子的质子数是53
【答案】B
【解析】A、图1微粒的第3、4电子层都已排满,则第2层也应排满,第2层最多排8个电子,则该微粒的核外电子数=2+8+18+18+8=54,核外电子数比核内的质子数多1个,为带1个单位的负电荷的微粒,图1表示的微粒是I—,正确;B、人体中碘是微量元素,不是常量元素,错误;C、图1微粒的第3、4电子层都已排满,则第2层也应排满,第2层最多排8个电子,所以X = 8,正确;D、根据元素周期表一格提供的信息,碘的原子序数为53,原子序数=质子数,所以碘原子的质子数是53,正确。故选B。

练习册系列答案
相关题目