题目内容
【题目】金属材料在生产和生活中有着广泛的应用,人类的生产和生活都离不开金属。
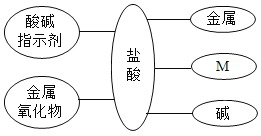
(1)工业上用含有金属元素的的矿石提炼金属,以下金属矿石中可用于炼铝的是_______
A黄铜矿(主要成分:CuFeS2) B铝土矿(主要成分:Al2O3)
C赤铁矿(主要成分:Fe2O3) D炉甘石(主要成分:ZnCO3)
(2)下图是某兴趣小组同学探究铁的相关性质的实验,请回答下列问题:
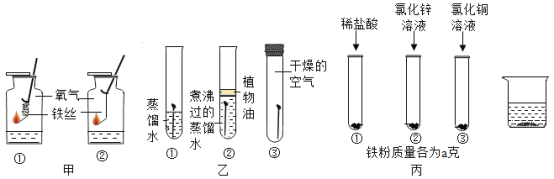
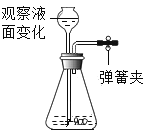
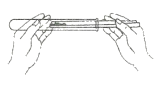
甲图中铁丝剧烈燃烧,但绕成螺旋状的铁丝燃烧更剧烈的原因是__________ 。
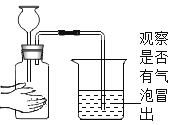
乙图是探究铁生锈条件的实验,其中________(填实验序号)比较说明铁生锈需要氧气参与。
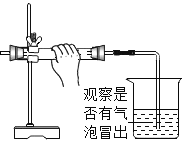
丙图中试管③的反应现象是____________;能证明铁、锌、铜三金属活动性顺序的最简实验为______。实验结束后,将3支试管内的物质全部倒入同一烧杯中(如图所示),充分反应后,烧杯中最后所得废液中可能含有的溶质是____________(填化学式)。
【答案】B 铁丝与氧气接触面积增大,使燃烧更剧烈 ①② 试管中有红色物质析出 ②③ HCl 、CuCl2
【解析】
(1)含有铝元素的金属矿石才可用来冶炼金属铝。故选B。
(2)细铁丝在氧气中能剧烈燃烧,且绕成螺旋状的铁丝比不绕成螺旋状的铁丝燃烧得更剧烈,现象更明显,原因是铁丝与氧气接触面积增大,使燃烧更剧烈。
乙图中试管①中的铁钉既与氧气接触,又与水接触发生了锈蚀;试管B中的铁钉只与煮沸的蒸馏水接触,即表示未和氧气接触,现象为没有锈蚀;试管C中的铁钉只与氧气接触,没有锈蚀,将试管①和②对比可知,铁生锈需要氧气。故选①②;
丙图中试管①铁粉和稀盐酸反应生成氯化亚铁和氢气,说明铁的活动性位于氢之前;试管②氯化锌和铁粉不反应,说明金属活动性顺序锌强于铁;试管③中铁和氯化铜溶液反应,生成红色的铜单质和氯化亚铁,反应现象是有红色固体生成,说明金属活动性顺序铁强于铜;故可知铁、锌、铜三金属活动性顺序由强到弱为锌、铁、铜,故能证明铁、锌、铜三金属活动性顺序的最简实验为②③。实验结束后,将3支试管内的物质全部倒入同一烧杯中(如图所示),充分反应后,烧杯中最后所得废液中一定有的溶质为氯化锌、氯化亚铁,可能含有的溶质是HCl 、CuCl2。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某实验探究小组用氢氧化钠溶液和稀硫酸进行中和反应的实验探究(如图甲)
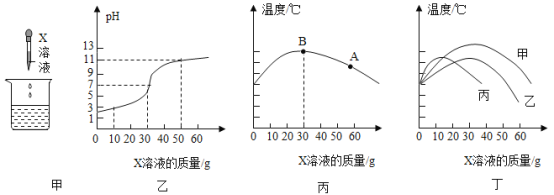
(1)写出该化学反应方程式_____。
(2)兴趣小组用 pH 探测仪测得烧杯内溶液 pH 的变化(如图乙),则实验中烧杯内所加入的溶液是_____。
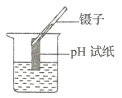
(3)兴趣小组同学用温度传感器测得烧杯内温度变化图像(如图丙) (实验过程中保温良好,热量散失忽略不计),该图说明该中和反应____________(吸热或者放热),为确定A 点对应的溶液中所含微粒,该同学设计如下实验。
操作 | 现象 | 结论 |
从烧杯内取少量溶液,向溶液中加入硫酸铜溶液 | ____________ | A 点对应的溶液中所含微粒有:_____ |
[实验反思]
实验小组其他同学也绘制了实验过程中温度变化图像(如图丁)(实验过程中保温良好,热量散失忽略不计)。实验中各同学所得温度变化图像不同的原因可能是________________。
【题目】兴趣小组同学利用下图装置、药品探究燃烧的条件。
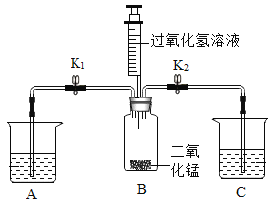
药品:白磷(着火点为40°C)、红磷(着火点为240°C)、过氧化氢溶液、二氧化锰固体。
(1)实验一:证明可燃物与氧气接触是燃烧条件之一。A、C中均放入一小块白磷和80°C热水。打开K1,关闭K2,向B中加入过氧化氢溶液。
①B中发生反应的化学方程式为_____________。
②能证明实验一目的的现象是_____________。
(2)实验二:证明可燃物的温度达到着火点是燃烧条件之一。小明和小红用控制变量的方法重新设计了两个不同的实验(装置同上,K1、K2均打开,向B中加入过氧化氢溶液),均可达到实验目的。请补全表格中的①②③。
小明实验 | 小红实验 | |||
A | C | A | C | |
固体 | 白磷 | 白磷 | 白磷 | ②________ |
液体 | 80°C热水 | ①________ | 80°C热水 | ③________ |