题目内容
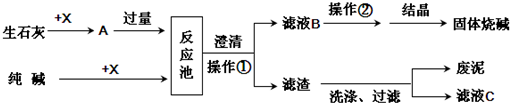
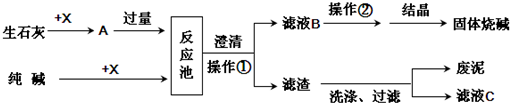
如图是某工厂生产烧碱的主要流程.
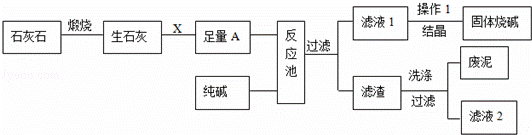
(1)X的化学式为 .
(2)该厂生产过程中煅烧了含碳酸钙75%的石灰石12t,理论上可制得氧化钙 t.
(3)足量的A与纯碱在反应池中反应的化学方程式为 .
(4)结晶得到的固体烧碱,经测定含有氢氧化钠的质量分数为99.2%,还含的少量的杂质,杂质是 ,原因是 .
(5)滤液2中的溶质的化学式为 ,为了降低生产成本和防止对环境造成污染,你的建议是 .
| (1)根据制取烧碱的原理可以知道,所需原料为氢氧化钙和碳酸钠,所以可以知道X为水,生石灰与水反应后生成了氢氧化钙,可以据此解答该题; (2)根据碳酸钙分解的化学方程式可以计算出可以制得的氧化钙的质量; (3)根据(1)中的分析可以知道,反应生成的A为氢氧化钙,氢氧化钙和碳酸钠反应生成了碳酸钙和氢氧化钠,可以据此写出该反应的化学方程式; (4)氢氧化钠易于空气中的二氧化碳发生反应,所以在氢氧化钠中会混有碳酸钠,可以据此解答该题; (5)根据反应过程可以知道能够溶于的滤渣只有氢氧化钙,所以可以判断滤液2中的溶质为氢氧化钙,而氢氧化钙可以重复利用,可以据此解答该题. | |
| 解答: | 解:(1)根据制取烧碱的原理可以知道,所需原料为氢氧化钙和碳酸钠,所以可以知道X为水,生石灰与水反应后生成了氢氧化钙,水的化学式为:H2O; (2)12t石灰石中含有的碳酸钙的质量为:12t×75%=9t; 设可以制得的氧化钙的质量为x CaCO3 100 56 9t x
解得:x=5.04t (3)根据(1)中的分析可以知道,反应生成的A为氢氧化钙,氢氧化钙和碳酸钠反应生成了碳酸钙和氢氧化钠,可以据此写出该反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH; (4)NaOH溶液在过滤、蒸发、结晶过程中吸收了空气中的CO2,与空气中的二氧化碳发生反应,所以在氢氧化钠中会混有碳酸钠; (5)根据反应过程可以知道能够溶于的滤渣只有氢氧化钙,所以可以判断滤液2中的溶质为氢氧化钙,而氢氧化钙是制取氢氧化钠的原材料,可以重复利用. 故答案为:(1)H2O; (2)5.04; (3)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH; (4)Na2CO3;NaOH溶液在过滤、蒸发、结晶过程中吸收了空气中的CO2气体; (5)Ca(OH)2;将滤液Ca(OH)2重新注入到反应池中循环利用. |

 CaO+CO2↑
CaO+CO2↑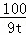 =
=