题目内容
将15g Cu和Zn的金属混合物粉末加入到一定量的稀硫酸中,恰好完全反应,将所得溶液进行过滤,得到2g固体(滤渣,不含结晶化合物)和200g滤液,则反应后溶液中溶质的质量分数应为( )A.6.5%
B.13.9%
C.15.1%
D.16.1%
【答案】分析:根据金属活动性锌>氢>铜,铜不与稀硫酸反应,因此,恰好完全反应后所剩余固体为铜;则金属混合物中锌的质量可由混合物质量与铜的质量差求得;
恰好完全反应后所得溶液为硫酸锌溶液,反应后溶液中溶质的质量分数= ,因此,需要根据反应的化学方程式,利用锌的质量计算出生成硫酸锌的质量.
,因此,需要根据反应的化学方程式,利用锌的质量计算出生成硫酸锌的质量.
解答:解:金属混合物中锌的质量=15g-2g=13g
设恰好完全反应时生成硫酸锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 161
13g x
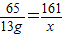
x=32.2g
则反应后溶液中溶质的质量分数=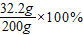 =16.1%
=16.1%
故选D.
点评:利用化学方程式表示反应中物质的质量关系,可由反应中已知物质的质量,计算反应中其它物质的质量.
恰好完全反应后所得溶液为硫酸锌溶液,反应后溶液中溶质的质量分数=
 ,因此,需要根据反应的化学方程式,利用锌的质量计算出生成硫酸锌的质量.
,因此,需要根据反应的化学方程式,利用锌的质量计算出生成硫酸锌的质量.解答:解:金属混合物中锌的质量=15g-2g=13g
设恰好完全反应时生成硫酸锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 161
13g x
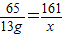
x=32.2g
则反应后溶液中溶质的质量分数=
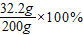 =16.1%
=16.1%故选D.
点评:利用化学方程式表示反应中物质的质量关系,可由反应中已知物质的质量,计算反应中其它物质的质量.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
将15g Cu和Zn的金属混合物粉末加入到一定量的稀硫酸中,恰好完全反应,将所得溶液进行过滤,得到2g固体(滤渣,不含结晶化合物)和200g滤液,则反应后溶液中溶质的质量分数应为( )
| A、6.5% | B、13.9% | C、15.1% | D、16.1% |