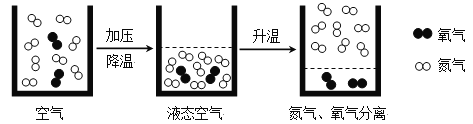
题目内容
【题目】A~J为中学化学常见的物质,它们之间的转化关系如图所示,部分产物已省略。已知A是人体胃酸的主要成分,B是发酵粉的主要成分之一,俗称小苏打。请回答:

(1)物质E为_____(填化学式)。
(2)反应③的化学方程式为_____。
(3)反应④中生成G和H的体积比为_____。
(4)A和B反应的化学方程式为_____。
(5)物质F的用途_____(写一种)。
【答案】NaCl 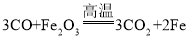 1:2
1:2 ![]() 做燃料或冶炼金属
做燃料或冶炼金属
【解析】
A~J为中学化学常见的物质,已知A是人体胃酸的主要成分,可推出A为盐酸,B是发酵粉的主要成分之一,俗称小苏打,可推出B为碳酸氢钠,碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,D能与碳在高温的条件下反应,且生成物F能与赤铁矿在高温的条件下反应,可推出D为二氧化碳,二氧化碳能与碳在高温的条件下反应生成一氧化碳,故F为一氧化碳,赤铁矿的主要成分是三氧化二铁,三氧化二铁能与一氧化碳在高温的条件下反应生成铁和二氧化碳,C在通电的条件下分解为G和H,可推出C为水,则E为氯化钠,水在通电的条件下分解为氧气和氢气,I能与G在点燃的条件下反应生成J,可推出I为铁,G为氧气,则H为氢气,铁在氧气中燃烧生成四氧化三铁,故J为四氧化三铁。
(1)物质E为氯化钠,化学式为:NaCl;
(2)反应③为三氧化二铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,该反应的化学方程式为: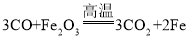
(3)反应④为水在通电的条件下反应生成氢气和氧气,G为氧气、H为氢气,在电解水实验中,生成氢气和氧气的体积比约为2:1,故生成G和H的体积比为:1:2;
(4)A为碳酸氢钠,B为盐酸,碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:![]() ;
;
(5)物质F为一氧化碳,一氧化碳具有可燃性,可做气体燃料,一氧化碳具有还原性,可用于冶炼金属等

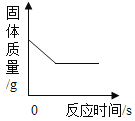
【题目】某实验小组的同学用氢氧化钙溶液和稀盐酸做中和反应实验时,向烧杯中的氢氧化钙溶液加入一定量稀盐酸后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式:______。
Ⅱ、探究烧杯内溶液中溶质的成分。
(提出问题)该烧杯内溶液中的溶质是什么?
(猜想)甲、乙、丙三位同学分别作出了猜想,请你补充丁同学的猜想。
同学甲:可能是![]() 和
和![]() ;同学乙:可能只有
;同学乙:可能只有![]() ;
;
同学丙:可能是![]() 、HCl和
、HCl和![]() ;同学丁:可能是__________________。
;同学丁:可能是__________________。
(查阅资料)氯化钙溶液呈中性。
(进行试验)
实验步骤 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量烧杯内溶液与试管中,滴入几滴酚酞溶液,振荡 | _______ | 同学甲猜想不正确 |
实验二 | 另取少量烧杯内溶液与试管中,逐滴加入碳酸钠溶液至过量 | 先有气体产生,后产生沉淀 | ______ 猜想正确 |
(反思与拓展)
烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是___________(写一条)。
要处理烧杯内溶液,使其溶质只含有![]() ,应向烧杯中加入过量的________。
,应向烧杯中加入过量的________。
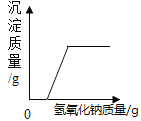
【题目】在化学实验探究课上,化学老师交给化学兴趣小组一包可能含有Na2SO4、NaNO2(亚硝酸钠)、NaCl(至少含有两种物质)的白色粉末,请你和同学们一起参与探究该白色粉末的主要成分。
(1)提出问题:该白色粉末的主要成分是什么?
(2)查阅资料
化学式 | 酸碱性 | 与稀盐酸作用 | 毒性 |
NaNO2 | 碱性 | 放出棕红色气体 | 有 |
NaC1 | 中性 | 不反应 | 无 |
(3)提出猜想:猜想Ⅰ:只含有NaCl、Na2SO4;猜想Ⅱ:只含有NaCl、NaNO2;猜想Ⅲ:只含有_____;猜想Ⅳ:含有Na2SO4、NaNO2、NaCl。
(4)进行探究
步骤 | 实验操作 | 实验现象 | 结论 |
步骤一 | 取少量固体样品于两支试管中,加蒸馏水溶解,向试管1滴入无色酚酞溶液,向试管2滴入过量的氯化钡溶液。 | 试管1:溶液变红色试管2:无明显现象 | 一定有_____ 一定没有_____ |
步骤二 | 另取适量固体样品于试管中,加蒸馏水溶解,滴加硝酸银溶液 | 有白色沉淀产生 | 一定有_____ |
(5)实验,猜想_________成立;
(6)写出步骤二中发生的化学方程式____________;
(7)拓展:粗盐中常含有可溶性和不溶性杂质,粗盐提纯的基本操作步骤是溶解、过滤、_____结晶。