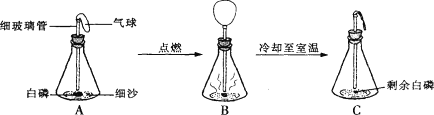
��Ŀ����
����Ŀ��ijͬѧ��������ʦ������������һ����ɫ�Ĺ��壬��ѯ��֪�����ֹ������Ҫ�ɷ��ǹ������ƣ�CaO2������Ϊ�˽��������������������⣮���ؼҺ�������ϣ��鵽����������ˮ��Ӧ��ԭ����2Na2O2+2H2O=4NaOH+O2������CaO2��Na2O2�Ļ�ѧ���ʷdz����ƣ�
��1��д��CaO2��H2O��Ӧ�Ļ�ѧ����ʽ__________��
��2����ͬѧΪ�ⶨ���ֹ�����CaO2��������������ȡ20g��Ʒ���뵽������ˮ�У��������3.2g O2��������Ʒ�������ɷ���ˮ����Ӧ������������������Ʒ��CaO2����������___��
���𰸡�2CaO2+2H2O=2Ca(OH)2+O2�� 72%
��������
��1����������������ˮ��Ӧ��ѧ����ʽ�еķ�Ӧ��������ģ��д������������ˮ��Ӧ�Ļ�ѧ����ʽ��
��2�����ݹ���������ˮ��Ӧ�Ļ�ѧ����ʽ������������������������Ʒ�й������Ƶ�������
��1�����ݹ���������ˮ��Ӧ�����������ƺ������ķ�Ӧ�ص㣬����������ˮ��Ӧ�����������ƺ���������Ӧ�Ļ�ѧ����ʽ��2CaO2+2H2O=2Ca(OH)2+O2����
��2������20g��Ʒ��CaO2������Ϊx

![]() ��֮�� x=14.4g
��֮�� x=14.4g
����Ʒ��CaO2����������=![]() =72%
=72%
�𣺸���Ʒ��CaO2����������Ϊ72%��