题目内容
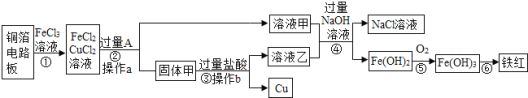
【题目】如图是某同学设计的实验室制取气体的装置,请完成下列问题:
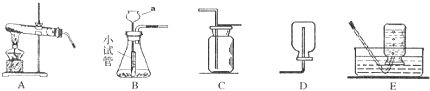
(1)写出图中a仪器的名称 ;
(2)实验室用装置B来制取二氧化碳气体,则仪器a中应盛放 溶液,化学反应方程式为 ,装置B中小试管的作用是 ;
(3)实验室中若使用68g30%的双氧水和一定量的MnO2混合制氧气,理论上可获得的氧气的质量为 .
【答案】(1)长颈漏斗;(2)稀盐酸;CaCO3+2HCl═CaCl2+H20+C02↑;
容易形成液封或防止产生的气体逸出(或节约液体的用量);(3)9.6g
【解析】(1)图中a仪器的名称是长颈漏斗;
(2)稀盐酸是液体,应放在长颈漏斗中,大理石应放在锥形瓶中;实验室用石灰石和稀盐酸反应制取二氧化碳的化学反应方程式为:CaCO3+2HCl═CaCl2+H20+C02↑;若没有小试管,锥形瓶中需要加许多液体药品才能让长颈漏斗下端的管口伸到液面下,还会造成液体药品的浪费,使用小试管容易形成液封,还会节约液体药品的用量;
(3)H2O2溶液中溶质的质量=68g×30%=20.4g,
设生成氧气的质量为x,
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
68 32
20.4g x
则![]() ,解得x=9.6g.
,解得x=9.6g.
答:生成氧气的质量为9.6g.

练习册系列答案
相关题目