题目内容
【题目】图1是某兴趣小组在学习碱的性质时进行的探究活动,请按要求回答问题:
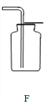
(1)通过分析实验一可知,氢氧化钠会吸收空气中的_____;
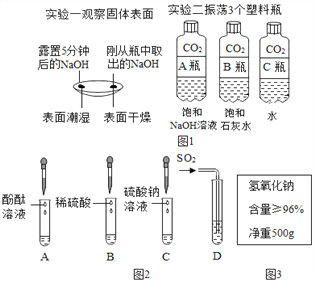
(2)实验二中观察到3个塑料瓶变瘪的程度为A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,其中C瓶在实验中起____作用;
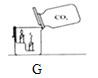
(3)晓晓查阅资料了解到往Ba(OH)2溶液中滴加或通入下列图2中物质会产生如下现象:A中溶液显红色,B、C、D中均产生白色沉淀;
①写出D试管中反应的化学方程式_________________;
②不同的碱溶液中都含有OH-,所以,碱有一些相似的化学性质。上述关于Ba(OH)2性质的实验不能体现碱的相似性质的是_____(填字母序号);
(4)冬冬发现工业上使用的氢氧化钠固体标签如图3所示,于是对其所含杂质进行了探究.
【提出问题】_______________________
【提出猜想】猜想Ⅰ:查阅资料可知,工业用氢氧化钠可能含有NaCl;
猜想Ⅱ:工业用氢氧化钠可能含有Na2CO3,原因是_______________(用简洁文字表述);
【进行实验】
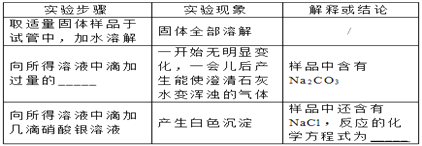
________________________________
【答案】 水 比对 Ba(OH)2 + SO2= BaSO3↓+H2O C 工业氢氧化钠的成分是什么? 氢氧化钠可以和空气中的二氧化碳反应生成碳酸钠 稀硝酸 AgNO3+NaCl=AgCl↓+NaNO3
【解析】(1)由上图实验一可知,氢氧化钠会吸收空气的 H2O,因此要密封保存;(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,对比A瓶、B瓶与 C瓶的实验现象可证明CO2 能与NaOH、Ca(OH)2发生反应;(3)①D试管中的反应是二氧化硫与氢氧化钡反应,化学方程式:Ba(OH)2+SO2═BaSO3↓+H2O;②根据碱的通性,碱可以和指示剂反应,可以和酸反应,可以与非金属氧化物反应,所以不能体现碱的相似性质的是C,故选C;(4)【提出问题】氢氧化钠含有什么杂质?【提出猜想】因为氢氧化钠与空气中的二氧化碳反应生成碳酸钠,所以可能含有碳酸钠;【进行实验】②根据能和碳酸钠反应产生能使澄清石灰水变浑浊的气体,说明加入的是酸,但又要排除后面银离子的干扰,所以只能滴加硝酸;③氯化钠和硝酸银反应,化学方程式:NaCl+AgNO3=AgCl↓+NaNO3。