题目内容
有一包白色粉末,可能由碳酸钡、碳酸钠、硫酸铜、硫酸钠和氯化钡的一种或几种组成.为了确定组成,某同学进行了如下的探究活动:
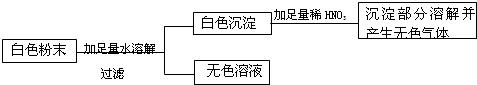
实验一:取少量白色粉末,加足量水溶解过滤,得白色沉淀与无色滤液.
实验二:取少量实验一得到的白色沉淀,加入足量的稀硝酸后,部分溶解,并有无色气体生成.由此,可以得出判断:
(1)白色粉末中一定没有(写化学式)
(2)实验一得到的沉淀是
(3)白色粉末的组成可能
实验一:取少量白色粉末,加足量水溶解过滤,得白色沉淀与无色滤液.
实验二:取少量实验一得到的白色沉淀,加入足量的稀硝酸后,部分溶解,并有无色气体生成.由此,可以得出判断:
(1)白色粉末中一定没有(写化学式)
CuSO4
CuSO4
;(2)实验一得到的沉淀是
BaCO3、BaSO4
BaCO3、BaSO4
;(3)白色粉末的组成可能
①Na2SO4 Na2CO3 BaCl2; ②Na2SO4 Na2CO3 BaCl2 BaCO3 ;③Na2SO4 BaCl2 BaCO3
①Na2SO4 Na2CO3 BaCl2; ②Na2SO4 Na2CO3 BaCl2 BaCO3 ;③Na2SO4 BaCl2 BaCO3
.分析:硫酸铜为白色固体,溶于水后其水溶液呈蓝色,碳酸钠能和氯化钡反应生成白色的碳酸钡沉淀,碳酸钡能于酸反应生成气体;氯化钡和硫酸钠可以反应生成不溶于水且不溶于酸的白色沉淀;要仔细分析每一实验步骤的用意及实验中所发生的化学反应,从而做出正确的判断.
解答:解:(1)把白色粉末溶解后得无色溶液,可知一定没有硫酸铜,因为硫酸铜溶于水会使溶液变蓝,故答案为:
(2)步骤1中的白色固体可能是碳酸钠和氯化钡反应生成白色的碳酸钡沉淀,也可能是硫酸钠与氯化钡反应后生成的硫酸钡沉淀,但是硫酸钡不溶于水而且不溶于酸,也可能是白色粉末中的碳酸钡,而题目中的白色沉淀部分溶于稀盐酸中,说明这种白色沉淀是碳酸钡和硫酸钡的混合物,所以加入稀盐酸后,碳酸钡溶解,那么最后剩余的是硫酸钡,故答案为:BaCO3、BaSO4
(3)由步骤1和步骤2可以分析出硫酸钠、氯化钡一定存在,硫酸铜一定不存在所以可能组合为:①Na2SO4 Na2CO3 BaCl2;②Na2SO4 Na2CO3 BaCl2 BaCO3 ;③Na2SO4 BaCl2 BaCO3;
故答案为:(1)CuSO4;(2)BaCO3、BaSO4;(3)①Na2SO4 Na2CO3 BaCl2; ②Na2SO4 Na2CO3 BaCl2 BaCO3 ;③Na2SO4 BaCl2 BaCO3.
(2)步骤1中的白色固体可能是碳酸钠和氯化钡反应生成白色的碳酸钡沉淀,也可能是硫酸钠与氯化钡反应后生成的硫酸钡沉淀,但是硫酸钡不溶于水而且不溶于酸,也可能是白色粉末中的碳酸钡,而题目中的白色沉淀部分溶于稀盐酸中,说明这种白色沉淀是碳酸钡和硫酸钡的混合物,所以加入稀盐酸后,碳酸钡溶解,那么最后剩余的是硫酸钡,故答案为:BaCO3、BaSO4
(3)由步骤1和步骤2可以分析出硫酸钠、氯化钡一定存在,硫酸铜一定不存在所以可能组合为:①Na2SO4 Na2CO3 BaCl2;②Na2SO4 Na2CO3 BaCl2 BaCO3 ;③Na2SO4 BaCl2 BaCO3;
故答案为:(1)CuSO4;(2)BaCO3、BaSO4;(3)①Na2SO4 Na2CO3 BaCl2; ②Na2SO4 Na2CO3 BaCl2 BaCO3 ;③Na2SO4 BaCl2 BaCO3.
点评:解答本题要掌握各种物质的性质和过程中的实验现象等方面的知识,只有这样才能对问题做出正确的判断;

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
(1)有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,经实验得到下表,请完成相关内容.
(2)某化学兴趣小组为测定该包白色粉末中碳酸钠的质量分数,取该样品44.6g,加286.2克水溶解制成溶液后投入146克稀盐酸中完全反应,共收集到二氧化碳气体8.8g.求:(1)该碳酸钠样品中碳酸钠的质量分数;(2)反应所得溶液中溶质的质量分数.
| 实验步骤及现象 | 结论 |
| ①将少许白色粉末溶于水得到无色溶液A | 白色粉末中一定没有 |
| ②在A中加入足量硝酸钡溶液,生成白色沉淀B,过滤得滤液C ③在白色沉淀B中加入足量稀硝酸, ④在滤液C中加入硝酸银溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解. |
白色粉末中一定有 碳酸钠和氯化钠 |
 (2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )
(2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )