题目内容
【题目】酸、碱、盐是几类重要的化合物。
(1)①焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为_________。
②浓硫酸和浓盐酸敞口放置均会变稀,这是为什么______?
③用石灰浆粉刷墙壁,干燥后墙面就变硬了,用化学方程式解释该现象______。
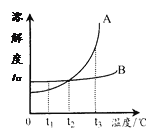
(2)如图是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
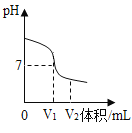
①根据图示判断,该实验是将_____________(填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。
②滴入溶液体积为V2mL时,溶液中的溶质为____________________。
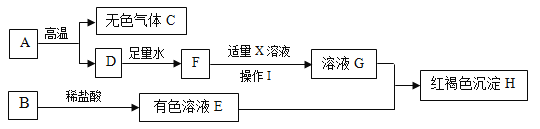
(3)为除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。[提示: Mg(OH)2、BaSO4、BaCO3难溶于水]
①以上操作合理的先后顺序为______________(数字序号不能重复使用)。
②请设计实验方案证明操作③所得溶液中含有Na2CO3和NaOH。______(写出实验步骤和现象)。
(4)为测定某石灰石样品中碳酸钙的质量分数,称取12g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为107.6g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数______。
【答案】小苏打 浓硫酸具有吸水性,浓盐酸具有挥发性 ![]() 硫酸 H2SO4、Na2SO4 ①②⑤③④ 取少量滤液,加入足量的CaCl2溶液(或BaCl2溶液),看到有白色沉淀出现,静置,取上层清液滴加酚酞,溶液变红 83.3%
硫酸 H2SO4、Na2SO4 ①②⑤③④ 取少量滤液,加入足量的CaCl2溶液(或BaCl2溶液),看到有白色沉淀出现,静置,取上层清液滴加酚酞,溶液变红 83.3%
【解析】
(1)①焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为小苏打。
②浓硫酸具有吸水性,会吸水空气中的水分,浓盐酸具有挥发性,会挥发出氯化氢气体,溶质质量变小,浓硫酸和浓盐酸敞口放置均会变稀,这是因为浓硫酸具有吸水性,浓盐酸具有挥发性。
③用石灰浆粉刷墙壁,干燥后墙面就变硬了是二氧化碳和氢氧化钙反应生成碳酸钙和水,反应的化学方程式为![]() 。
。
(2)①由氢氧化钠溶液与硫酸反应时溶液pH变化的示意图可知,开始溶液的pH大于7,显碱性,反应完全,溶液的pH小于7,显酸性,说明是将硫酸滴加到氢氧化钠溶液中,故该实验是将硫酸滴加到另一种溶液中。
②滴入溶液体积为V2mL时,溶液的pH小于7,显酸性,说明硫酸过量,溶液中的溶质为硫酸和氢氧化钠反应生成的硫酸钠和过量的硫酸,故溶质为H2SO4 、Na2SO4。
(3)①氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,所加试剂都是过量所以会带入新的杂质,因此也要除去,碳酸钠能和氯化钡反应生成碳酸钡沉淀和氯化钠,所以碳酸钠必须在氯化钡之后加入,碳酸钠、氢氧化钠都和盐酸反应生成生成氯化钠,所以可以用盐酸除去,但氢氧化镁、碳酸钙、碳酸钡也能和盐酸反应,所以必须过滤后加盐酸,故合理的先后顺序为①②⑤③④。
②氯化钙和碳酸钠反应生成碳酸钙和氯化钠,氯化钡和碳酸钠反应生成碳酸钡和氯化钠,氢氧化钠显碱性,能使无色酚酞溶液变红色,故证明操作③所得溶液中含有Na2CO3和NaOH的实验步骤和现象为取少量滤液,加入足量的CaCl2溶液(或BaCl2溶液),看到有白色沉淀出现,静置,取上层清液滴加酚酞,溶液变红。
(4)由质量守恒定律可知,反应前的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量,则生成的二氧化碳的质量为![]()
设该样品中碳酸钙的质量为x
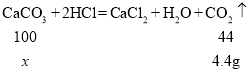
![]()
![]()
故该样品中碳酸钙的质量分数为![]() 。
。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】由于![]() 能作
能作![]() 溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧化物是否也可以作
溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧化物是否也可以作![]() 溶液分解的催化剂?请你参与他们的探究过程.
溶液分解的催化剂?请你参与他们的探究过程.
(1)[猜想]:![]() 能作过氧化氢分解的催化剂.
能作过氧化氢分解的催化剂.
(2)[实验验证]:
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | ________ |
实验二 | ________ | 木条复燃 |
|
(3)[结论]:故![]() 能作
能作![]() 溶液分解的催化剂.
溶液分解的催化剂.
(4)[讨论与思考]:有的同学认为只有上述两个实验,不能完全证明![]() 在
在![]() 溶液分解中起了催化作用.还应补充一个上述反应前后
溶液分解中起了催化作用.还应补充一个上述反应前后![]() 质量是否改变的探究实验.
质量是否改变的探究实验.
实验三:①准确称量![]() (少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行:________;④________.
(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行:________;④________.
(5)有同学认为,即使实验三中![]() 在反应前后质量不变,要证明猜想.上述三个实验还不足够,仍需要再探究
在反应前后质量不变,要证明猜想.上述三个实验还不足够,仍需要再探究![]() 的________.
的________.
【题目】某化学兴趣小组的同学在做“二氧化碳的实验室制取及性质”实验时,发现长时间向澄清石灰水中通入二氧化碳,石灰水先变浑浊,后又变澄清,加热澄清的液体又变浑浊。请教老师后知道:难溶的碳酸钙能与二氧化碳和水反应,生成易溶解的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2。碳酸氢钙受热易分解:Ca(HCO3)2 ![]() CaCO3↓+H2O+CO2↑。他们对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓厚的兴趣。
CaCO3↓+H2O+CO2↑。他们对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓厚的兴趣。
(提出问题)
一定量CO2与NaOH溶液反应后的溶液中溶质组成是什么?
(查阅资料)
(1)通入少量CO2,反应的化学方程式为: __________________;
(2)通入过量CO2,反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3;
(3)碳酸氢盐都是可溶于水的,BaCO3难溶于水。
(提出猜想)
(1)溶质为Na2CO3;
(2)溶质为NaHCO3;
(3)溶质为NaOH和Na2CO3;
(4)溶质为___________(填化学式)。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
A. 取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液 | 有____生成 | 猜想(2)不成立 |
B. 取步骤a中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(3)不成立 |
(得出结论)
猜想(4)成立。
(讨论交流)
试写出NaHCO3受热分解的化学方程式: ___________。