题目内容
【题目】为测定某AgNO3溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定。现取待测液50.0g,滴定过程如图所示。(计算结果均保留1位小数)
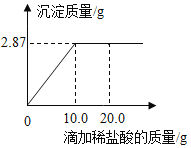
(1)当AgNO3与HCl恰好完全反应时,消耗7.3%的稀盐酸的质量为:____;
(2)当稀盐酸的质量滴加至20.0g时,溶液中的溶质为_____(写出化学式)
(3)计算AgNO3溶液的溶质质量分数_____。
【答案】10.0g HNO3、HCl 6.8%
【解析】
硝酸银和稀盐酸反应生成白色沉淀氯化银和硝酸。根据反应的化学方程式和图像进行计算。
(1)恰好完全反应时,应该是图像当中的拐点。可以看出,加入10.0g稀盐酸时,恰好完全反应。故答案为:10.0g;
(2)当稀盐酸的质量滴加至20.0g时,通过图像可以分析出,当滴加到10.0g时,稀盐酸和硝酸银恰好完全反应,继续加入稀盐酸,则稀盐酸过量。此时的溶质应为反应生成的硝酸和过量的盐酸。故答案为:HNO3、HCl;
(3)解:设参加反应的硝酸银的质量为x。
由图像可知,稀盐酸和硝酸银恰好完全反应时,消耗HCl的质量为:10.0g×7.3%=0.73g。
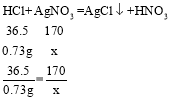
解得x=3.4g。所以硝酸银溶液的溶质质量分数为:![]() 。
。
答:硝酸银溶液的溶质质量分数为6.8%。
故答案为:(1)10.0g(2)HNO3、HCl(3)6.8%

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目