题目内容
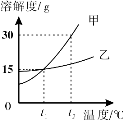
【题目】下列图像与所对应操作相符的是
A.氢氧化钠溶液加水稀释
B.将镁片和铁片(均足量)分别和等质量、等溶质质量分数的稀硫酸混合
C.向HCl与Na2SO4混合溶液中加入Ba (OH) 2溶液
D.用两份等质量、等浓度的双氧水分别制取氧气
【答案】B
【解析】
试题分析:氢氧化钠溶液加水稀释但是溶液的PH不会变为小于7;将镁片和铁片(均足量)分别和等质量、等溶质质量分数的稀硫酸混合,镁的活动性大于铁的,所以镁先反应完,但是酸的量不足,所以产生气体的量要根据酸来定,因此最后的气体量相等;向HCl与Na2SO4混合溶液中加入Ba (OH) 2溶液,后立刻产生沉淀硫酸钡,因为硫酸钡不会和酸反应;所以沉淀开始就能产生;用两份等质量、等浓度的双氧水分别制取氧气,有无催化剂只是影响反应的速率,但不会影响产生的物质的量。故选B.

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案【题目】(14分)请完成下列相关内容:
Ⅰ.实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。
(1)铁在潮湿的空气中易生锈,铁锈的主要成分为 ;铁在氧气中能剧烈燃烧,现象为 ,反应的化学方程式为 。
(2)铜在潮湿的空气中也容易锈蚀生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],铜锈蚀除了与氧气有关外,还与空气中的 有关。
(3)铝在空气中具有很好的抗腐蚀性能,其原因是 。
Ⅱ.过氧化钠(Na2O2)是一种淡黄色固体,能与水或二氧化碳反应放出氧气。实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分。

【提出问题】变质的过氧化钠粉末中有哪些成分?
【查阅资料】2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2CO2═2Na2CO3+O2
【猜想与假设】(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是 的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
……
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
①取3.00g变质粉末于一支大试管中,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体。 | 固体完全溶解, | 该固体样品中含有Na2O2,其质量为 g。 |
②继续向上述试管中加入足量的石灰水,充分反应。 | 化学方程式 。 | |
③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g。 |
【得出结论】同学们经过实验和计算分析,该固体样品中所含物质有 。
【拓展应用】过氧化钠(Na2O2)是供氧设备中常用的供氧剂。若将15.6g过氧化钠与足量的二氧化碳充分反应,理论上生成的氧气质量是多少?(写出计算过程)。
【题目】(8分)在一次用餐中,同学们对燃料“固体酒精”产生了好奇,于是对其成分进行研究.
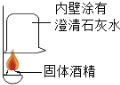 【查阅资料】(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成.
【查阅资料】(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成.
【提出问题】(1)酒精中是否含有碳元素?(2)固体酒精中的氢氧化钠是否变质?
【实验探究】
(1)按如图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论.此结论 (选填“合理”或“不合理”)
(2)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀.取沉淀于试管中加稀盐酸,有气泡产生.写出产生气体的化学方程式
分析实验并结合资料得出氢氧化钠已变质.
(3)为进一步确定氢氧化钠的变质程度,同学们设计了如下实验方案,请你一起完成下列实验报告.
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入过量的 BaCl2溶液 | 该反应的化学方程式为 | |
(2)将上述反应后的混合液过滤,取滤液加入 ; | 固体酒精中的氢氧化钠部分变质 |
(4)【反思交流】判断实验操作(1)中所加BaCl2溶液是否过量的方法
(5)【拓展应用】要除去实验室部分变质的氢氧化钠溶液中的少量杂质,可选择适量的___(填字母)
A.Ba(OH)2溶液 B.CaCl2溶液 C.Ca(OH)2溶液