题目内容
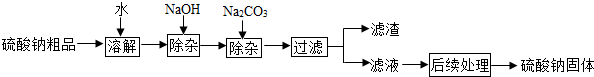
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaSO4和MgSO4,实验室进行提纯的流程如下:(提示:本题中微溶物质当可溶物质)
试回答下列问题:
(1)加入NaOH和Na2CO3时,反应的化学方程式分别为
(2)如果NaOH和Na2CO3添加过量了,可在过滤
(3)“后续处理”的主要操作是蒸发;蒸发时用玻璃棒不断搅拌,其作用是

试回答下列问题:
(1)加入NaOH和Na2CO3时,反应的化学方程式分别为
2NaOH+MgCl2═Mg(OH)2↓+2NaCl
2NaOH+MgCl2═Mg(OH)2↓+2NaCl
,Na2CO3+CaCl2═CaCO3↓+2NaCl
Na2CO3+CaCl2═CaCO3↓+2NaCl
.(2)如果NaOH和Na2CO3添加过量了,可在过滤
后
后
(填前或后)加入适量H2SO4
H2SO4
溶液.(3)“后续处理”的主要操作是蒸发;蒸发时用玻璃棒不断搅拌,其作用是
使液体均匀受热
使液体均匀受热
,蒸发操作中应有大量固体析出
有大量固体析出
时停止加热.分析:(1)根据本题给出的除去杂质选用的试剂,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,写出反应的化学方程式即可.
(2)如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂的原则.
(3)根据蒸发操作的原理、注意事项,解答在蒸发过程中玻璃棒的作用、停止加热的时机.
(2)如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂的原则.
(3)根据蒸发操作的原理、注意事项,解答在蒸发过程中玻璃棒的作用、停止加热的时机.
解答:解:(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式分别为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl,Na2CO3+CaCl2═CaCO3↓+2NaCl.
(2)稀硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质;碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳气体,没有带入任何其它杂质;符合除杂的原则,故除去过量的氢氧化钠和碳酸钠时,可在过滤后向滤液中滴加稀硫酸除去.
(3)①为使液体均匀受热,蒸发时用玻璃棒不断搅拌,以防止受热不均匀而使液体溅出;
②蒸发操作中应在有大量固体析出时停止加热,利用余热蒸干.
故答案为:(1)2NaOH+MgCl2═Mg(OH)2↓+2NaCl;Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)后;H2SO4;
(3)①使液体均匀受热;②有大量固体析出;
(2)稀硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质;碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳气体,没有带入任何其它杂质;符合除杂的原则,故除去过量的氢氧化钠和碳酸钠时,可在过滤后向滤液中滴加稀硫酸除去.
(3)①为使液体均匀受热,蒸发时用玻璃棒不断搅拌,以防止受热不均匀而使液体溅出;
②蒸发操作中应在有大量固体析出时停止加热,利用余热蒸干.
故答案为:(1)2NaOH+MgCl2═Mg(OH)2↓+2NaCl;Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)后;H2SO4;
(3)①使液体均匀受热;②有大量固体析出;
点评:本题综合性较强,主要考查了盐的化学性质、化学方程式的书写、蒸发操作等,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
 A.完全蒸干时停止加热
A.完全蒸干时停止加热


