题目内容
【题目】从微观的角度了解物质及其变化,有助于更好的认识物质组成和变化的本质。
(1)锂原子的结构示意图为![]() ,则x=_______,在元素周期表中锂元素位于_________周期,在化学反应中锂原子易_________________(填“得到”或“失去”)电子。
,则x=_______,在元素周期表中锂元素位于_________周期,在化学反应中锂原子易_________________(填“得到”或“失去”)电子。
(2)硫原子得到2个电子形成离子,其离子符号为________________。
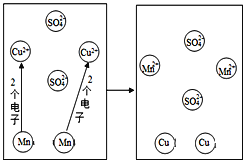
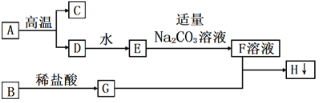
(3)下图为锰(Mn)和CuSO4溶液反应的示意图(锰离子符号为Mn2+),回答下列问题:
①反应中Mn与Cu2+的个数比为____________。
②反应中失去电子的粒子是_____________。硫酸铜中硫元素化合价为_________。
③由反应可知金属的活泼性:Cu_________Mn(填“>”或“<”)。
【答案】 3 2 失去 S2— 1∶1 锰原子(或Mn) +6 <
【解析】本题主要考查了原子结构示意图,元素周期表的特点,金属的化学性质;微粒模型图的应用等。
(1)在原子中,质子数=核外电子数,x=2+1=3,元素周期序数等于该元素原子的电子层数,锂原子核外有两个电子层,在元素周期表中锂元素位于2周期;当原子的最外层电子少于4个时,容易失去最外层的电子,达到稳定结构,锂原子的最外层电子数为1,在化学反应中锂原子易失去电子;
(2)硫原子得到2个电子形成离子,其离子符号为S2—;
(3)根据锰(Mn)和CuSO4溶液反应的示意图可知,①反应中Mn与Cu2+的个数比=1∶1;②由于Mn变成了Mn2+,所以反应中失去电子的粒子是:锰原子(或Mn);在硫酸铜中,氧元素的化合价为-2价,铜元素的化合价为+2价,设:硫元素化合价为x,根据化合物中元素的化合价的代数和为零,则有(+2)+x+(-2)×4=0,x=+6,硫酸铜中硫元素化合价为+6;
③由反应可知,Mn能将Cu从其盐溶液中置换出来,金属的活泼性: Cu< Mn。

 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
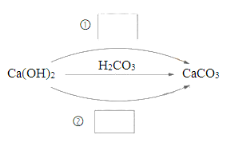
导学与测试系列答案【题目】⑴化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质__________(填化学式)实现Ca(OH)2一步转化为CaCO3。
⑵某Ca(OH)2 样品部分变质为CaCO3 (假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH)2 的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸_____g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
反应时间/min | 0 | t1 | t2 | t3 |
烧杯总质量/g | 280.0 | 278.9 | 277.8 | 277.8 |
完全反应后,生成的CO2气体的质量为___________g。
③数据处理:计算该样品中Ca(OH)2 的质量分数________(根据化学方程式的计算写出完整的计算步骤)。